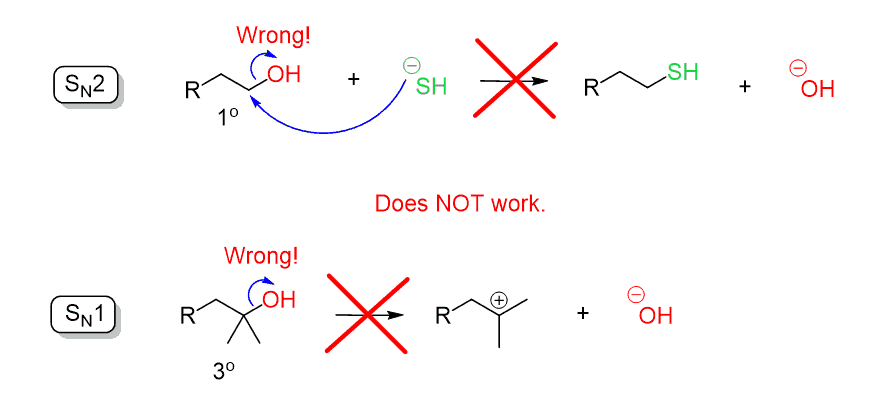
muista, kun käsittelimme substituutioreaktioita, että hydroksidi–ioni (- OH) on huono lähtevä ryhmä, koska se on melko vahva emäs. Tämän vuoksi OH: ta ei voida karkottaa suoralla nukleofiilisella hyökkäyksellä SN2 – tai SN1-reaktiossa:
yksi tapa muuntaa alkoholeja substituutioreaktioissa alkyylihalideiksi on reagoida niihin voimakkaiden happojen kuten HCl: n, HBr: n ja HI: n kanssa tai käyttämällä tionyylikloridia (SOCl2) tai fosforitribromidia (PBr3). Molemmissa lähestymistavoissa tämän muutoksen taustalla oli OH: n muuttaminen hyväksi lähteväksi ryhmäksi.

näiden menetelmien lisäksi OH voidaan myös muuntaa hyväksi lähteväksi ryhmäksi reagoimalla sulfonyylikloridien kuten p-Tolueenisulfonyylikloridin (TsCl), Metaanisulfonyylikloridin (MsCl) ja Trifluorimetaanisulfonyylikloridin (TfCl)kanssa:

tuloksena syntyviä tuotteita kutsutaan Tosylaateiksi (- OTs), Mesylaateiksi (- OMs) ja Triflaateiksi (- OTf), jotka kaikki ovat erinomaisia lähteviä ryhmiä ja joita voidaan käyttää substituutio-ja eliminaatioreaktioissa.:

miksi joudumme hankaloittamaan elämäämme ja käsittelemään tosylaatteja ja mesylaatteja, jos reaktio happojen kanssa toimii hyvin?
yleisesti ottaen alkyylisulfonaattien käyttö on parempi vaihtoehto HX-hapoille kontrolloimaan reaktion stereokemiaa ja myös välttämään vahvojen happojen käyttöä.
joten mikä tarkalleen on hyödyllistä reaktion stereokemialle?
muista, että yksi ongelma happojen käytössä on mahdollinen SN1-mekanismi, joka muodostaa karbokationin ja voi johtaa stereokemian menetykseen ja tiettyjen alkoholien uudelleenjärjestelyihin.:

toisin kuin Alkoholit, mesylaatit ja tosylaatit reagoivat aina suolan, kuten NaCl: n tai NaBr: n kanssa happojen sijaan. Suolojen avulla pyritään varmistamaan, että halogeenit ovat hyvinä nukleofiileina, koska protonit eivät tukahduta niitä ja reaktio menee SN2-mekanismilla. Happoa ei tarvitse käyttää, koska OH on jo hyvä lähtö, mikä on toinen etu, koska reaktio suoritetaan lievemmissä olosuhteissa.
on myös syytä mainita, että mesylaatteja ja tosylaatteja ei käytetä ainoastaan alkoholien halogenointiin. He yksinkertaisesti muuntavat OH: n hyväksi lähteväksi ryhmäksi, jonka jälkeen he voivat osallistua mihin tahansa substituutio-ja eliminaatioreaktioon.:
hyvä on, olemme keskustelleet tässä vaiheessa näiden reagenssien käytöstä, mutta miten ne toimivat, mikä on mesylaation ja tosylaation mekanismi?
tarkastellaan tätä yksitellen:
verrataan kahta reaktiota hyvään nukleofiiliin:

miksi ensimmäinen reaktio ei toimi, kun toinen toimii hienosti? Miksi tosylaatti on parempi lähtijä kuin OH?
jos muistit resonanssivakautuksen, hyvin tehty-sitähän se on. Siinä missä OH-ryhmän happi kantaa yksin koko negatiivisen varauksen, sulfonaatti-ionilla on kolme happea käsittelemään negatiivista varausta, joka on parempi kuin hydroksyyliryhmän ainoa:

keskustellaan mekanismista, jolla (R)-2-butanoli muunnetaan tosylaatiksi, jota seuraa SN2-mekanismin kautta tapahtuva substituutioreaktio.
ensimmäisessä vaiheessa alkoholi toimii nukleofiilina, joka hyökkää rikkiä vastaan kloridin tilalle.
huomaa, että hiili, jolla on stereogeeninen keskus, ei ole mukana tässä vaiheessa ja sen konfiguraatio säilyy edelleen:

pyridiini lisätään emäkseksi deprotonoimaan Välituote ja nopeuttamaan Tolueenisulfonaattiesterin (tosylaatin) muodostumisprosessia.
tämän vaiheen jälkeen OH: sta muodostuu hyvä lähtevä ryhmä, jonka nukleofiili voi potkaista ulos:

Mesylaatio kulkee hieman eri mekanismilla. Ensimmäinen vaihe tässä on happaman ɑ-protonin deprotonointi emäksen avulla metaanisulfonyylikloridista, joka muodostaa sulfeenin. Sulfeeni on hyvin elektrofiilinen ja reagoi nopeasti alkoholin kanssa:

nämä reaktiot on usein esitetty mekanismi näimme tosylation perustutkintoa kursseja.
Kysy ohjaajaltasi, onko mesylaatiolle hyväksyttävä sama mekanismi kuin tosylaatiolle.
reaktiivisen sulfeeniväliaineen muodostuminen antaa mesylaatille pienen edun tertiääristen alkoholien kanssa työskenneltäessä, koska ne reagoivat hyvin hitaasti TsCl: n kanssa.
tosylaation etuna on se, että se on suurempi molekyyli ja muuttaa osan nestemäisestä alkoholista kiinteiksi aineiksi, joita joskus suositaan, koska niitä on helpompi käsitellä. Myös tosylaattien aromaattinen rengas mahdollistaa paremman visualisoinnin TLC-levyllä.
mutta jälleen kerran se, että se on suurempi, tekee sen valmistamisesta hieman hitaampaa, eikä se ole yhtä reaktiivinen myöskään substituutioreaktioissa.
Triflaatti-ioni on myös erinomainen lähtevä ryhmä, mutta sitä ei käsitellä niin paljon perustutkinnon oppikirjoissa, joten emme mene liikaa yksityiskohtiin vastaavista mekanismeista.
käsitteellisesti eroa ei kuitenkaan ole – se lyhennetään vain TF: ksi Ts: n tai Ms: n sijaan ja sitä voi yksinkertaisesti pitää hyvänä lähtijäryhmänä harjoitusta tehdessä.
Mesylaatit ja Tosylaatit SN1-reaktioissa
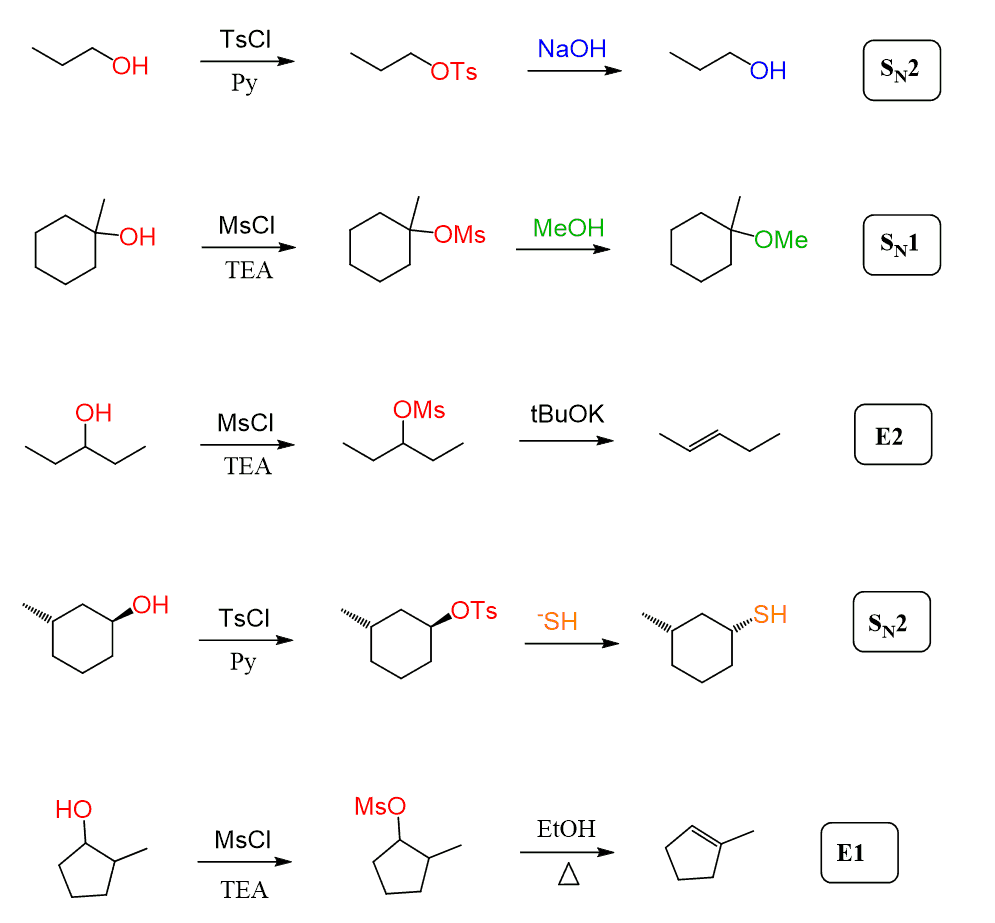
kaikissa edellä mainituissa esimerkeissä on havaittu, että tosylaatit ja mesylaatit reagoivat aina voimakkaiden nukleofiilien kanssa, kun ne muuttuvat alkyylihalideiksi, ja näissä tapauksissa SN2-mekanismi on vallitseva.
mesylaatit ja tosylaatit voivat kuitenkin käydä läpi myös SN1-ja E1-eliminaatioreaktioita, kun käytetään tertiääristä alkoholia tai heikkoa nukleofiiliä:

yleensä nämä eivät vaikuta periaatteisiin, joiden mukaan määritellään, kulkeeko reaktio SN1 -, SN2 -, E1-vai E2-mekanismin kautta.

nukleofiilinen substituutio-ja Eliminaatiokysely
ota nyt