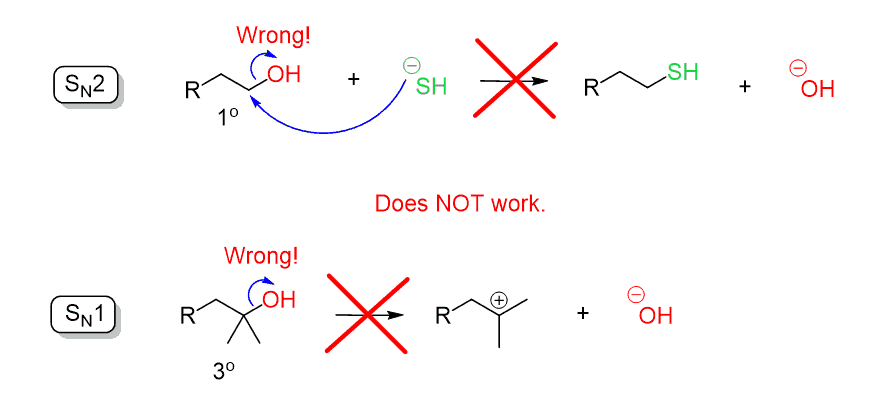
pamiętaj, że omawiając reakcje podstawienia, powiedzieliśmy, że Jon wodorotlenku (–OH) jest słabą grupą opuszczającą, ponieważ jest dość silną zasadą. Dlatego OH nie może być wydalony przez bezpośredni atak nukleofilowy w reakcji SN2 lub SN1:
jednym ze sposobów przekształcania alkoholi w reakcjach substytucji na halogenki alkilowe jest reakcja ich z silnymi kwasami, takimi jak HCl, HBr i HI lub z użyciem chlorku tionylu (SOCl2) lub tribromku fosforu (pbr3). W obu podejściach zasadą stojącą za tą transformacją było przekształcenie OH w grupę dobrego odejścia.

oprócz tych metod, OH można również przekształcić w dobrą grupę opuszczającą przez reakcję z chlorkami sulfonylowymi, takimi jak chlorek P-Toluenosulfonylu (TsCl), chlorek Metanosulfonylu (MsCl) i chlorek Trifluorometanosulfonylu (TfCl):

otrzymane produkty nazywane są Tosylanami (- OTs), Mesylanami (- OMs) I Triflatami (- OTf), z których wszystkie są doskonałymi grupami opuszczającymi i mogą być stosowane w reakcjach substytucji i eliminacji:

pytanie brzmi, dlaczego musimy komplikować nasze życie i zajmować się tosylanami i mezylanami, jeśli reakcja z kwasami działa dobrze, prawda?
Ogólnie rzecz biorąc, stosowanie sulfonianów alkilowych jest lepszą alternatywą dla kwasów HX do kontrolowania stereochemii reakcji, a także unikania stosowania silnych kwasów.
więc co dokładnie jest korzystne dla stereochemii reakcji?
pamiętaj, że jednym z problemów z użyciem kwasów jest możliwy mechanizm SN1, który tworzy karbokację i może prowadzić do utraty stereochemii i przegrupowania niektórych alkoholi:

w przeciwieństwie do alkoholi, mezylany i tosylany są zawsze reagowane z solą, taką jak NaCl lub NaBr, a nie kwasami. Zastosowanie soli ma zapewnić, że halogeny są w postaci dobrych nukleofilów, ponieważ nie są tłumione przez protony, a reakcja przebiega przez mechanizm SN2. Nie ma potrzeby stosowania kwasu, ponieważ OH jest już dobrym wyjściem, co jest kolejną zaletą, ponieważ reakcja odbywa się w łagodniejszych warunkach.
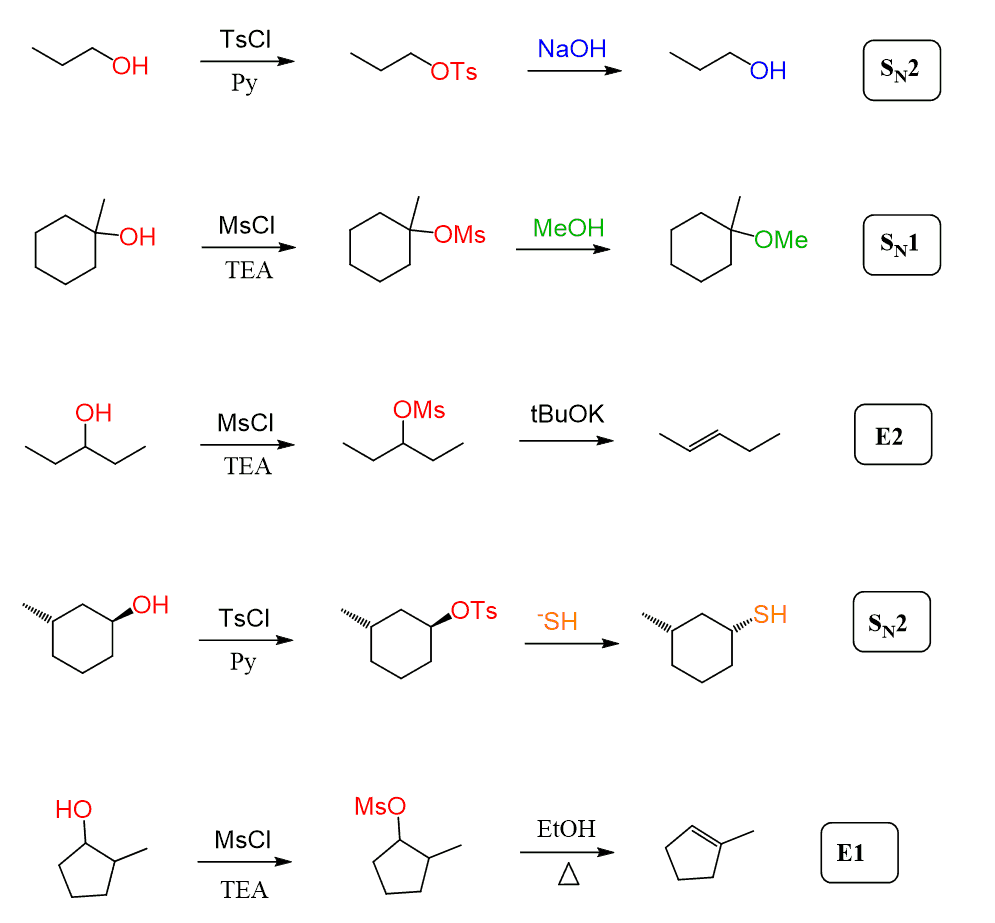
warto również wspomnieć, że mezylany i tosylany nie są używane tylko do halogenowania alkoholi. Po prostu przekształcają OH w dobrą grupę opuszczającą, po której mogą uczestniczyć w dowolnej reakcji substytucji i eliminacji:
w porządku, omówiliśmy w tym miejscu pomysł użycia tych odczynników, ale jak one działają, jaki jest mechanizm mezylacji i tosylacji?
zajmijmy się tym jeden po drugim:
porównajmy dwie reakcje z dobrym nukleofilem:

dlaczego pierwsza reakcja nie działa, podczas gdy druga działa bardzo ładnie? Dlaczego tosylat jest lepszy od OH?
jeśli przypomniałeś sobie stabilizację rezonansu, dobra robota-o to chodzi. Podczas gdy tlen grupy OH sam w sobie nosi pełny ładunek ujemny, jon sulfonianowy ma trzy atomy tlenu do obsługi ładunku ujemnego, który jest lepszy niż jedyny w grupie hydroksylowej:

omówmy mechanizm przekształcania (R) – 2-butanolu w tosylan, po którym następuje reakcja podstawienia za pomocą mechanizmu SN2.
w pierwszym etapie alkohol działa jak nukleofil atakujący siarkę w celu zastąpienia chlorku.
zauważ, że węgiel z centrum stereogenicznym nie jest zaangażowany w ten krok, a jego konfiguracja jest nadal zachowana:

pirydynę dodaje się jako zasadę do deprotonacji półproduktu i przyspiesza proces tworzenia estru toluenosulfonianowego (tosylanu).
po tym kroku OH zmienia się w dobrą grupę opuszczającą, którą może wykopać nukleofil:

Mezylacja przebiega przez nieco inny mechanizm. Pierwszym etapem jest deprotonacja kwaśnego protonu ɑ przez zasadę z chlorku metanosulfonylu, który tworzy sulfen. Sulfen jest bardzo elektrofilowy i szybko reaguje z alkoholem:

reakcje te będą często pokazywane za pomocą mechanizmu, który widzieliśmy w przypadku tosylacji na studiach licencjackich.
zapytaj swojego instruktora, czy ten sam mechanizm co w przypadku tosylacji jest dopuszczalny do mezylacji.
tworzenie reaktywnego związku pośredniego sulfenu daje niewielką przewagę mesylatowi podczas pracy z alkoholami trzeciorzędowymi, ponieważ reagują bardzo wolno z TsCl.
zaletą tosylacji jest to, że jest to większa cząsteczka i zamienia część ciekłego alkoholu w Ciała stałe, które czasami są preferowane, ponieważ są łatwiejsze w obsłudze. Ponadto pierścień aromatyczny tosylanów pozwala na lepszą wizualizację na płytce TLC.
ale po raz kolejny fakt, że jest większy, sprawia, że jego przygotowanie jest nieco wolniejsze i nie jest tak reaktywne w reakcjach substytucyjnych.
jon Triflanowy jest również doskonałą grupą opuszczającą, jednak nie jest tak bardzo omawiany w podręcznikach licencjackich, dlatego nie będziemy zbytnio zagłębiać się w szczegóły dotyczące odpowiednich mechanizmów.
jednak koncepcyjnie nie ma różnicy – będzie to tylko Skrót Tf zamiast Ts lub Ms i można po prostu traktować go jako dobrą grupę opuszczającą podczas pracy nad ćwiczeniem.
Mezylany i Tosylany w reakcjach SN1
we wszystkich powyższych przykładach widzieliśmy, że tosylany i mezylany zawsze reagują z silnymi nukleofilami po przekształceniu w halogenki alkilowe i w tych przypadkach dominuje mechanizm SN2.
jednak mezylany i tosylany mogą również ulegać reakcjom eliminacji SN1 i E1, gdy stosuje się trzeciorzędowy alkohol lub słaby nukleofil:

ogólnie rzecz biorąc, nie wpływają one na zasady określania, czy reakcja przechodzi przez mechanizm SN1, SN2, E1 lub E2.

test praktyczny podstawienia i eliminacji Nukleofilowych
weź teraz