Rappelez-vous lors de la discussion des réactions de substitution, nous avons dit que l’ion hydroxyde (–OH) est un groupe de départ médiocre car il s’agit d’une base assez forte. Par conséquent, l’OH ne peut pas être expulsé par une attaque nucléophile directe dans une réaction SN2 ou SN1:
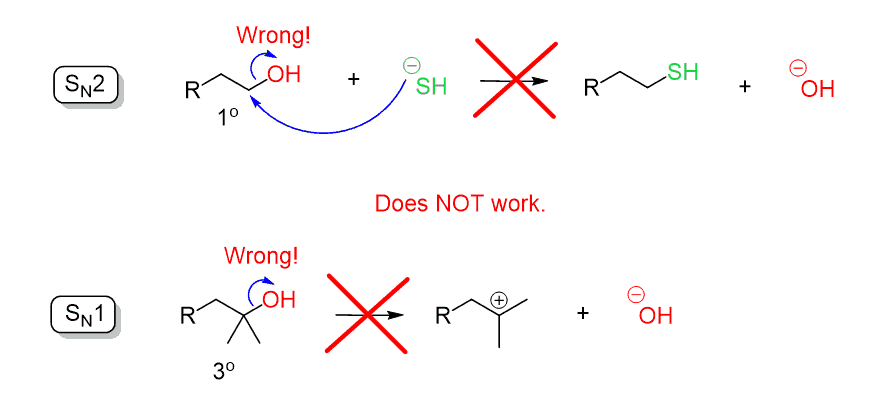
Une façon de convertir les alcools dans des réactions de substitution en halogénures d’alkyle est de les faire réagir avec des acides forts tels que HCl, HBr et HI ou en utilisant du chlorure de thionyle (SOCl2) ou du tribromure de phosphore (PBr3). Dans les deux approches, le principe de cette transformation était la conversion de l’OH en un bon groupe partant.

En plus de ces méthodes, l’OH peut également être converti en un bon groupe partant en réagissant avec des chlorures de sulfonyle tels que le chlorure de p-Toluènesulfonyle (TsCl), le chlorure de Méthanesulfonyle (MsCl) et le chlorure de Trifluorométhanesulfonyle (TfCl):

Les produits obtenus sont appelés Tosylates (-OTs), Mésylates (-OMs) et Triflates (-OTf) qui sont tous d’excellents groupes de départ et peuvent être utilisés dans des réactions de substitution et d’élimination:

Maintenant, la question est de savoir pourquoi devons-nous compliquer nos vies et traiter les tosylates et les mésylates si la réaction avec les acides fonctionne très bien, non?
Eh bien, en général, l’utilisation de sulfonates d’alkyle est une meilleure alternative aux acides HX pour contrôler la stéréochimie de la réaction et éviter également l’utilisation d’acides forts.
Alors, qu’est-ce qui est exactement bénéfique pour la stéréochimie de la réaction?
Rappelez-vous, un problème avec l’utilisation des acides est le mécanisme SN1 possible qui forme un carbocation et peut entraîner une perte de stéréochimie et des réarrangements pour certains alcools:

Contrairement aux alcools, les mésylates et les tosylates réagissent toujours avec un sel tel que NaCl ou NaBr et non les acides. L’utilisation de sels est de s’assurer que les halogènes sont sous une forme de bons nucléophiles car ils ne sont pas supprimés par les protons et la réaction passe par le mécanisme SN2. Pas besoin d’utiliser un acide puisque l’OH est déjà une bonne sortie ce qui est un autre avantage car la réaction s’effectue dans des conditions plus douces.
Il convient également de mentionner que les mésylates et les tosylates ne sont pas utilisés uniquement pour l’halogénation des alcools. Ils convertissent simplement l’OH en un bon groupe de départ après quoi ils peuvent participer à toute réaction de substitution et d’élimination:
D’accord, nous avons discuté, à ce stade, de l’idée d’utiliser ces réactifs mais comment fonctionnent-ils, quel est le mécanisme de mésylation et de tosylation?
Abordons ceci un par un:
Comparons deux réactions avec un bon nucléophile:

Comment se fait-il que la première réaction ne fonctionne pas alors que la seconde fonctionne très bien? Pourquoi le tosylate est-il un meilleur groupe de départ que le OH?
Si vous avez rappelé la stabilisation par résonance, bravo – c’est ce que c’est. Alors que l’oxygène du groupe OH porte seul la charge négative complète, l’ion sulfonate a trois oxygènes pour gérer la charge négative, ce qui est mieux que le seul du groupe hydroxyle:

Discutons du mécanisme de conversion du (R)-2-Butanol en un tosylate suivi d’une réaction de substitution via le mécanisme SN2.
Dans un premier temps, l’alcool agit comme un nucléophile attaquant le soufre pour remplacer le chlorure.
Notez que le carbone avec le centre stéréogène n’est pas impliqué dans cette étape et que sa configuration est toujours conservée:

La pyridine est ajoutée comme base pour déprotoner l’intermédiaire et accélérer le processus de formation de l’ester de toluènesulfonate (tosylate).
Après cette étape, le OH est maintenant transformé en un bon groupe partant qui peut être expulsé par un nucléophile:

La mésylation passe par un mécanisme légèrement différent. La première étape ici est la déprotonation du proton acide ɑ par la base à partir du chlorure de méthanesulfonyle qui forme un sulfène. Le sulfène est très électrophile et réagit rapidement avec l’alcool:

Ces réactions seront souvent montrées avec le mécanisme que nous avons vu pour la tosylation dans les cours de premier cycle.
Demandez à votre instructeur si le même mécanisme que pour la tosylation est acceptable pour la mésylation.
La formation de l’intermédiaire sulfénique réactif donne un léger avantage au mésylate lorsqu’on travaille avec des alcools tertiaires car ils réagissent très lentement avec le TsCl.
L’avantage de la tosylation est qu’il s’agit d’une molécule plus grosse et transforme un peu d’alcool liquide en solides qui sont parfois préférés car plus faciles à manipuler. De plus, le cycle aromatique des tosylates permet une meilleure visualisation sur une plaque CCM.
Mais encore une fois, le fait qu’il soit plus gros rend sa préparation un peu plus lente et il n’est pas aussi réactif dans les réactions de substitution.
L’ion triflate est également un excellent groupe de départ, cependant, il n’est pas tellement couvert dans les manuels de premier cycle, par conséquent, nous n’entrerons pas trop dans les détails sur les mécanismes correspondants.
Cependant, conceptuellement, il n’y a pas de différence – il sera seulement abrégé en Tf au lieu de Ts ou Ms et vous pouvez simplement le traiter comme un bon groupe de départ lorsque vous travaillez sur un exercice.
Mésylates et Tosylates dans les réactions SN1
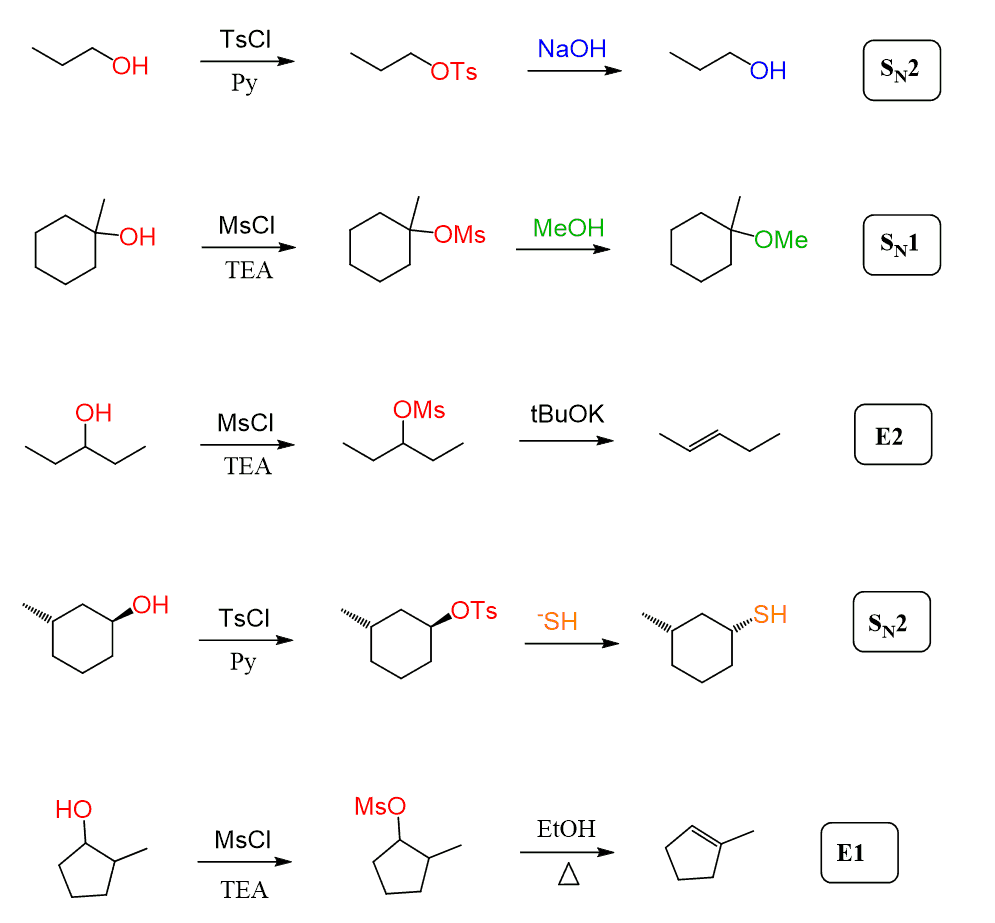
Dans tous les exemples ci-dessus, nous avons vu que les tosylates et les mésylates réagissent toujours avec des nucléophiles forts lorsqu’ils sont convertis en halogénures d’alkyle et dans ces cas, le mécanisme SN2 prédominera.
Cependant, les mésylates et les tosylates peuvent également subir des réactions d’élimination SN1 et E1 lorsqu’un alcool tertiaire ou un nucléophile faible est utilisé:

En général, ceux-ci n’affectent pas les principes de détermination si la réaction passe par un mécanisme SN1, SN2, E1 ou E2.

Quiz Pratique sur la Substitution et l’Élimination Nucléophiles
Prenez maintenant