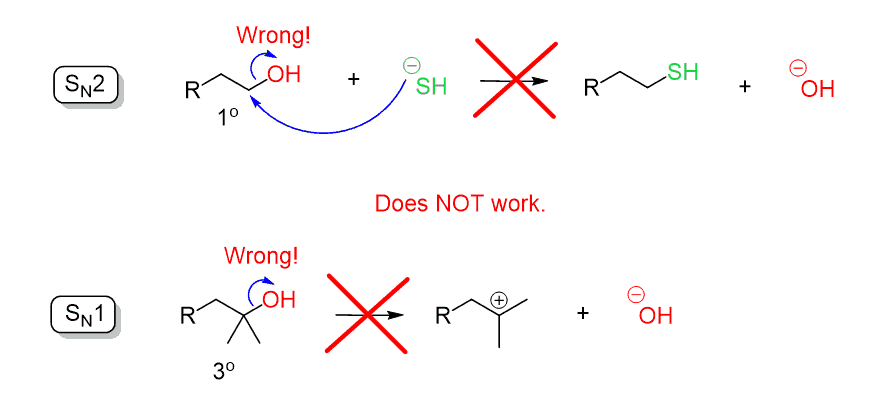
kom ihåg när vi diskuterade substitutionsreaktionerna sa vi att hydroxidjonen (–OH) är en dålig lämnande grupp eftersom den är ganska stark bas. Därför kan OH inte utvisas av en direkt nukleofil attack i en SN2 – eller SN1-reaktion:
ett sätt att omvandla alkoholer i substitutionsreaktioner mot alkylhalogenider är att reagera dem med starka syror såsom HCl, HBr och HI eller använda tionylklorid (SOCl2) eller fosfortribromid (PBr3). I båda tillvägagångssätten var principen bakom denna omvandling omvandlingen av OH till en bra lämnande grupp.

förutom dessa metoder kan OH också omvandlas till en bra lämnande grupp genom att reagera med sulfonylklorider såsom p-Toluensulfonylklorid (TsCl), Metansulfonylklorid( MsCl) och Trifluormetansulfonylklorid (TfCl):

de resulterande produkterna kallas Tosylater (- OTs), Mesylater (-oms) och Triflater (-OTf) som alla är utmärkta lämnande grupper och kan användas vid substitutions-och elimineringsreaktioner:

nu är frågan Varför behöver vi komplicera våra liv och hantera tosylater och mesylater om reaktionen med syror fungerar bra, eller hur?
Tja, i allmänhet är användningen av alkylsulfonater ett bättre alternativ till HX-syror för att kontrollera reaktionens stereokemi och även undvika användning av starka syror.
så vad är exakt fördelaktigt för reaktionens stereokemi?
kom ihåg att ett problem med att använda syrorna är den möjliga SN1-mekanismen som bildar en karbokalisering och kan leda till förlust av stereokemi och omarrangemang för vissa alkoholer:

till skillnad från alkoholer reageras mesylater och tosylater alltid med ett salt som NaCl eller NaBr och inte syrorna. Användningen av salter är att säkerställa att halogenerna är i form av goda nukleofiler eftersom de inte undertrycks av protonerna och reaktionen går genom SN2-mekanismen. Inget behov av att använda en syra eftersom OH redan är en bra lämnande vilket är en annan fördel eftersom reaktionen utförs vid mildare förhållanden.
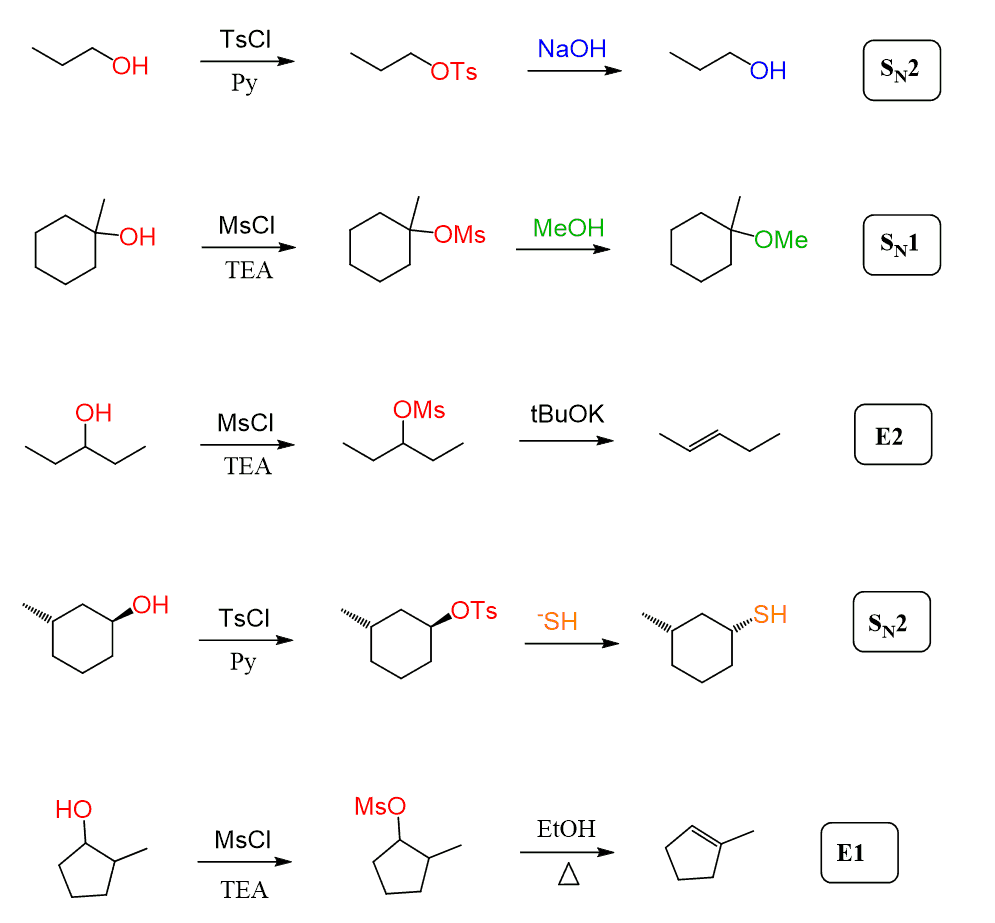
det är också värt att nämna att mesylater och tosylater inte bara används för halogenering av alkoholer. De omvandlar enkelt OH till en bra lämnande grupp, varefter de kan delta i någon substitutions-och elimineringsreaktion:
Okej, vi har just nu diskuterat tanken på att använda dessa reagenser men hur fungerar de, vad är mekanismen för mesylering och tosylering?
låt oss ta itu med den här en efter en:
låt oss jämföra två reaktioner med en bra nukleofil:

Hur kommer den första reaktionen inte fungerar medan den andra fungerar väldigt snyggt? Varför är tosylaten en bättre lämnande grupp än OH?
om du återkallade resonansstabiliseringen, bra gjort-det är vad det är. Medan syret i OH-gruppen bär den fulla negativa laddningen på egen hand, sulfonatjonen har tre oxygener för att hantera den negativa laddningen som är bättre än den enda i hydroxylgruppen:

låt oss diskutera mekanismen för omvandling (R) – 2-Butanol till ett tosylat följt av en substitutionsreaktion via SN2-mekanismen.
i det första steget fungerar alkoholen som en nukleofil som attackerar svavel för att ersätta kloriden.
Lägg märke till att kolet med det stereogena centret inte är involverat i detta steg och dess konfiguration fortfarande behålls:

pyridin tillsätts som en bas för att deprotonera mellanprodukten och påskynda processen att bilda Toluensulfonatestern (tosylat).
efter detta steg förvandlas OH nu till en bra lämnande grupp som kan sparkas ut av en nukleofil:

Mesylering går genom en något annorlunda mekanism. Det första steget här är deprotonering av den sura sackarioproton genom basen från metansulfonylklorid som bildar en sulfen. Sulfen är mycket elektrofil och reagerar snabbt med alkoholen:

dessa reaktioner kommer ofta att visas med den mekanism vi såg för tosylering i grundkurser.
fråga din instruktör om samma mekanism som för tosylering är acceptabel för mesylering.
bildningen av den reaktiva sulfenmellanprodukten ger en liten fördel för mesylat när man arbetar med tertiära alkoholer eftersom de reagerar mycket långsamt med TsCl.
fördelen med tosylering är att det är en större molekyl och förvandlar lite flytande alkohol till fasta ämnen som ibland föredras eftersom de är lättare att hantera. Den aromatiska ringen av tosylaterna möjliggör också bättre visualisering på en TLC-platta.
men än en gång, det faktum att det är större gör dess beredning lite långsammare och det är inte lika reaktivt i substitutionsreaktioner också.
Triflate ion är också en utmärkt lämnande grupp, men den täcks inte så mycket i grundböcker, därför kommer vi inte att gå för mycket in i detaljer om motsvarande mekanismer.
men konceptuellt är det ingen skillnad-det kommer bara att förkortas som Tf istället för Ts eller Ms och du kan helt enkelt behandla det som en bra lämnande grupp när du arbetar med en övning.
Mesylater och Tosylater i SN1-reaktioner
i alla exemplen ovan har vi sett att tosylater och mesylater alltid reageras med starka nukleofiler när de omvandlas till alkylhalogenider och i dessa fall kommer SN2-mekanismen att dominera.
mesylater och tosylater kan emellertid också genomgå SN1-och E1-elimineringsreaktioner när en tertiär alkohol eller en svag nukleofil används:

i allmänhet påverkar dessa inte principerna för att bestämma om reaktionen går igenom en SN1 -, SN2 -, E1-eller E2-mekanism.

Nucleophilic Substitution and Elimination Practice Quiz
ta nu