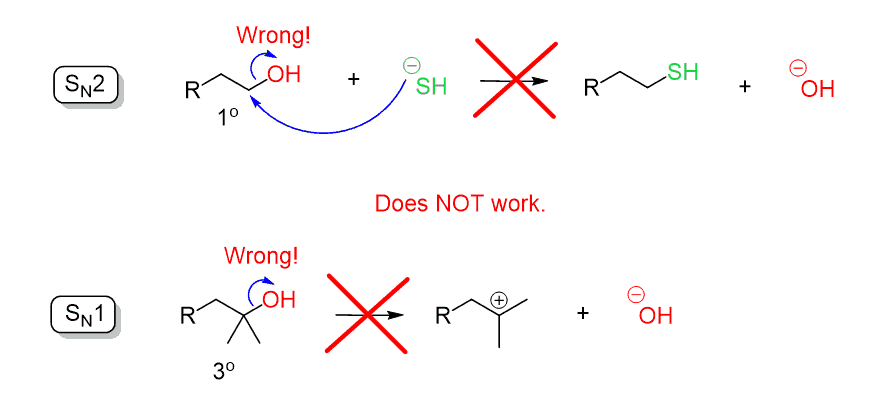
Denken Sie daran, dass wir bei der Erörterung der Substitutionsreaktionen gesagt haben, dass das Hydroxidion (–OH) eine schlechte Abgangsgruppe ist, da es eine ziemlich starke Base ist. Daher kann das OH nicht durch einen direkten nukleophilen Angriff in einer SN2- oder SN1-Reaktion ausgestoßen werden:
Eine Möglichkeit, Alkohole in Substitutionsreaktionen in Alkylhalogenide umzuwandeln, besteht darin, sie mit starken Säuren wie HCl, HBr und HI oder mit Thionylchlorid (SOCl2) oder Phosphortribromid (PBr3) umzusetzen. In beiden Ansätzen war das Prinzip hinter dieser Transformation die Umwandlung der OH in eine gute Abgangsgruppe.

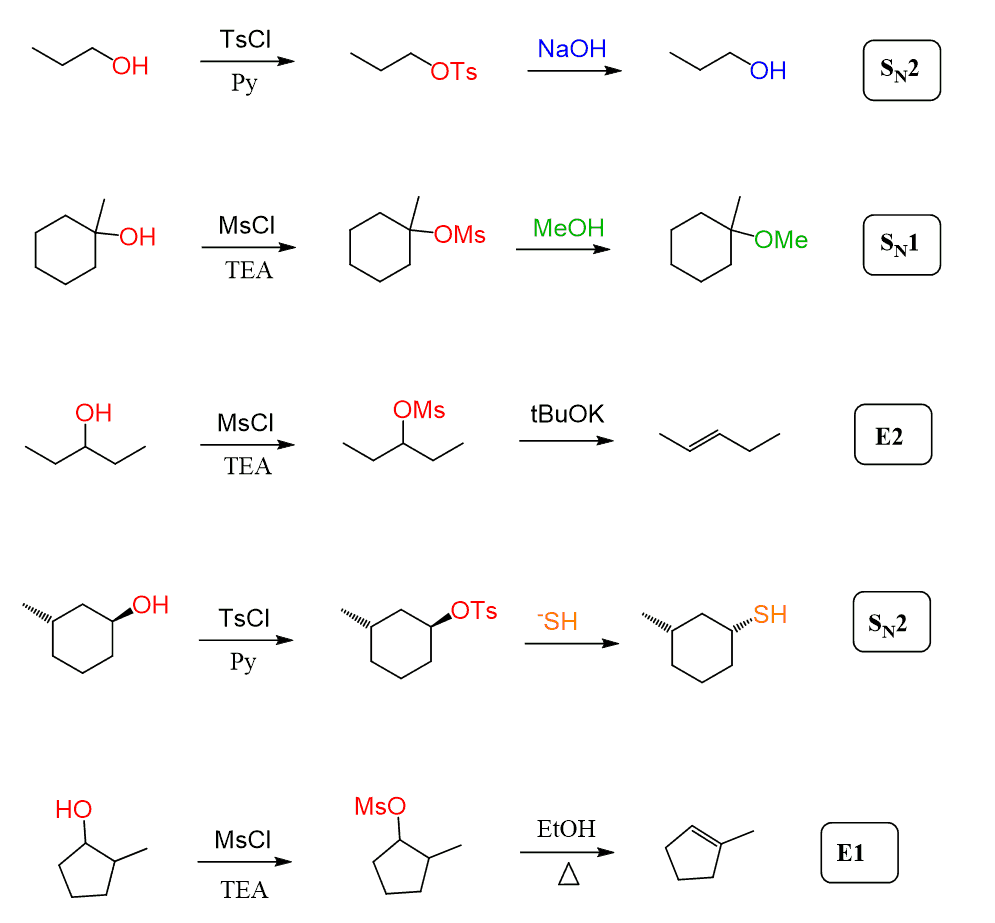
Zusätzlich zu diesen Methoden kann das OH auch durch Umsetzung mit Sulfonylchloriden wie p-Toluolsulfonylchlorid (TsCl), Methansulfonylchlorid (MsCl) und Trifluormethansulfonylchlorid (TfCl) in eine gute Abgangsgruppe umgewandelt werden:

Die resultierenden Produkte werden Tosylate (-OTs), Mesylate (-OMs) und Triflate (-OTf) genannt, die alle ausgezeichnete Abgangsgruppen sind und in Substitutions- und Eliminationsreaktionen verwendet werden können:

Nun, die Frage ist, warum müssen wir unser Leben komplizieren und mit Tosylaten und Mesylaten umgehen, wenn die Reaktion mit Säuren gut funktioniert, oder?
Nun, im Allgemeinen ist die Verwendung von Alkylsulfonaten eine bessere Alternative zu HX-Säuren, um die Stereochemie der Reaktion zu steuern und auch die Verwendung starker Säuren zu vermeiden.
Was genau ist also vorteilhaft für die Stereochemie der Reaktion?
Denken Sie daran, dass ein Problem bei der Verwendung der Säuren der mögliche SN1-Mechanismus ist, der ein Carbokation bildet und zum Verlust der Stereochemie und zu Umlagerungen für bestimmte Alkohole führen kann:

Im Gegensatz zu Alkoholen werden Mesylate und Tosylate immer mit einem Salz wie NaCl oder NaBr und nicht mit den Säuren umgesetzt. Die Verwendung von Salzen soll sicherstellen, dass die Halogene in Form von guten Nukleophilen vorliegen, da sie nicht durch die Protonen unterdrückt werden und die Reaktion durch den SN2-Mechanismus abläuft. Keine Notwendigkeit, eine Säure zu verwenden, da das OH bereits ein guter Katalysator ist, was ein weiterer Vorteil ist, da die Reaktion bei milderen Bedingungen durchgeführt wird.
Es ist auch erwähnenswert, dass Mesylate und Tosylate nicht nur zur Halogenierung von Alkoholen verwendet werden. Sie wandeln das OH einfach in eine gute Abgangsgruppe um, nach der sie an jeder Substitutions- und Eliminationsreaktion teilnehmen können:
Okay, wir haben an dieser Stelle die Idee diskutiert, diese Reagenzien zu verwenden, aber wie funktionieren sie, was ist der Mechanismus der Mesylierung und Tosylierung?
Lassen Sie uns dies einzeln angehen:
Vergleichen wir zwei Reaktionen mit einem guten Nukleophil:

Wie kommt es, dass die erste Reaktion nicht funktioniert, während die zweite sehr gut funktioniert? Warum ist das Tosylat eine bessere Abgangsgruppe als das OH?
Wenn Sie sich an die Resonanzstabilisierung erinnern, gut gemacht – das ist es. Während der Sauerstoff der OH-Gruppe allein die volle negative Ladung trägt, Das Sulfonation hat drei Sauerstoffstoffe, um die negative Ladung zu handhaben, die besser ist als die einzige in der Hydroxylgruppe:

Lassen Sie uns den Mechanismus zur Umwandlung von (R) -2-Butanol in ein Tosylat diskutieren, gefolgt von einer Substitutionsreaktion über den SN2-Mechanismus.
Im ersten Schritt wirkt der Alkohol als Nukleophil, das den Schwefel angreift, um das Chlorid zu ersetzen.
Beachten Sie, dass der Kohlenstoff mit dem stereogenen Zentrum an diesem Schritt nicht beteiligt ist und seine Konfiguration weiterhin erhalten bleibt:

Das Pyridin wird als Base zugegeben, um das Zwischenprodukt zu deprotonieren und den Prozess der Bildung des Toluolsulfonatesters (Tosylat) zu beschleunigen.
Nach diesem Schritt wird das OH nun in eine gute Abgangsgruppe umgewandelt, die von einem Nukleophilen rausgeschmissen werden kann:

Die Mesylierung erfolgt nach einem etwas anderen Mechanismus. Der erste Schritt ist hier die Deprotonierung des sauren ɑ Protons durch die Base aus Methansulfonylchlorid, das ein Sulfen bildet. Das Sulfen ist sehr elektrophil und reagiert schnell mit dem Alkohol:

Diese Reaktionen werden oft mit dem Mechanismus gezeigt, den wir für die Tosylierung in Grundstudiengängen gesehen haben.
Fragen Sie Ihren Instruktor, ob der gleiche Mechanismus wie bei der Tosylierung für die Mesylierung akzeptabel ist.
Die Bildung des reaktiven Sulfenzwischenprodukts bietet Mesylat einen leichten Vorteil bei der Arbeit mit tertiären Alkoholen, da diese sehr langsam mit TsCl reagieren.
Der Vorteil der Tosylierung besteht darin, dass sie ein größeres Molekül ist und etwas flüssigen Alkohol in Feststoffe umwandelt, die manchmal bevorzugt werden, da sie einfacher zu handhaben sind. Auch der aromatische Ring der Tosylate ermöglicht eine bessere Visualisierung auf einer DC-Platte.
Aber noch einmal, die Tatsache, dass es größer ist, macht seine Herstellung etwas langsamer und es ist auch bei Substitutionsreaktionen nicht so reaktiv.
Triflate Ion ist auch eine ausgezeichnete Abgangsgruppe, es wird jedoch nicht so sehr in Lehrbüchern für Studenten behandelt, daher werden wir nicht zu sehr auf die entsprechenden Mechanismen eingehen.
Konzeptionell gibt es jedoch keinen Unterschied – es wird nur als Tf anstelle von Ts oder Ms abgekürzt und Sie können es einfach als gute Abgangsgruppe behandeln, wenn Sie an einer Übung arbeiten.
Mesylate und Tosylate in SN1-Reaktionen
In allen obigen Beispielen haben wir gesehen, dass Tosylate und Mesylate immer mit starken Nukleophilen umgesetzt werden, wenn sie in Alkylhalogenide umgewandelt werden, und in diesen Fällen wird der SN2-Mechanismus überwiegen.
Mesylate und Tosylate können jedoch auch SN1- und E1-Eliminationsreaktionen eingehen, wenn ein tertiärer Alkohol oder ein schwaches Nukleophil verwendet wird:

Im Allgemeinen beeinflussen diese nicht die Prinzipien der Bestimmung, ob die Reaktion einen SN1-, SN2-, E1- oder E2-Mechanismus durchläuft.

Nucleophile Substitution und Elimination Practice Quiz
Jetzt nehmen