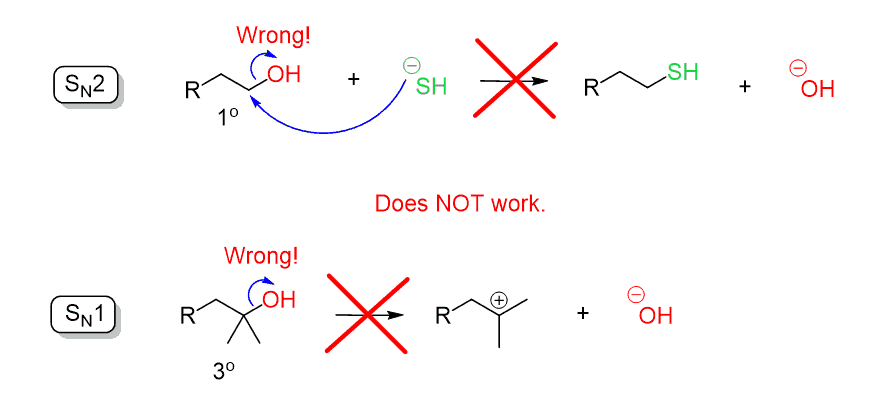
Husk når du diskuterer substitusjonsreaksjonene, sa vi at hydroksidionet (- OH) er en dårlig forlatingsgruppe siden det er ganske sterk base. DERFOR KAN OH ikke utvises ved et direkte nukleofilt angrep i EN SN2 eller SN1-reaksjon:
en måte å konvertere alkoholer i substitusjonsreaksjoner til alkylhalogenider er ved å reagere dem med sterke syrer Som HCl, HBr og HI eller ved bruk av tionylklorid (SOCl2) eller fosfortribromid (PBr3). I begge tilnærmingene var prinsippet bak denne transformasjonen konverteringen AV OH til en god forlatelsesgruppe.

I tillegg til disse metodene KAN OH også omdannes til en god forlatingsgruppe ved å reagere med sulfonylklorider som p-Toluenesulfonylklorid (TsCl), Metanesulfonylklorid( MsCl) og Trifluormetanesulfonylklorid (TfCl):

de resulterende produktene kalles Tosylater (- OTs), Mesylater (-OMs) og Triflater (- OTf) som alle er gode forlater grupper og kan brukes i substitusjon og eliminering reaksjoner:

nå er spørsmålet hvorfor trenger vi å komplisere våre liv og håndtere tosylater og mesylater hvis reaksjonen med syrer fungerer bra, ikke sant?
vel, generelt er bruken av alkylsulfonater et bedre alternativ TIL hx-syrer for å kontrollere reaksjonens stereokjemi og også unngå bruk av sterke syrer.
så hva er egentlig gunstig for reaksjonens stereokjemi?
Husk at et problem med å bruke syrene er den mulige SN1-mekanismen som danner en karbokasjon og kan føre til tap av stereokjemi og omarrangementer for visse alkoholer:

i Motsetning til alkoholer reagerer mesylater og tosylater alltid med et salt som Nacl eller NaBr og ikke syrer. Bruken av salter er å sikre at halogenene er i form av gode nukleofiler, da de ikke undertrykkes av protonene, og reaksjonen går AV SN2-mekanismen. Du trenger ikke å bruke en syre siden OH er allerede en god forlater som er en annen fordel fordi reaksjonen utføres ved mildere forhold.
det er også verdt å nevne at mesylater og tosylater ikke bare brukes til halogenering av alkoholer. De enkelt konvertere OH til en god forlater gruppe etter som de kan delta i noen substitusjon og eliminering reaksjon:
Ok, vi har diskutert ideen om å bruke disse reagensene, men hvordan fungerer de, hva er mekanismen for mesylering og tosylering?
la oss ta opp denne en etter en:
la oss sammenligne to reaksjoner med en god nukleofil:

Hvordan kommer den første reaksjonen ikke fungerer mens den andre fungerer veldig pent? Hvorfor er tosylate en bedre forlate gruppe enn OH?
hvis du husket resonans stabilisering, godt gjort-det er hva det er. Mens oksygen AV OH-gruppen bærer full negativ ladning på egen hånd, sulfonat ion har tre oksygener for å håndtere den negative ladning som er bedre enn den eneste i hydroksylgruppen:

la oss diskutere mekanismen for konvertering (R)-2-Butanol til et tosylat etterfulgt av en substitusjonsreaksjon via SN2-mekanismen.
i det første trinnet virker alkoholen som en nukleofil som angriper svovelet for å erstatte kloridet.
Legg Merke til at karbonet med stereogen senter ikke er involvert i dette trinnet, og konfigurasjonen er fortsatt beholdt:

pyridinet tilsettes som en base for å deprotonere mellomproduktet og fremskynde prosessen med å danne Toluenesulfonatesteren (tosylat).
ETTER dette trinnet blir OH nå omgjort til en god forlatelsesgruppe som kan kastes ut av en nukleofil:

Mesylering går av en litt annen mekanisme. Det første trinnet her er deprotonasjonen av det sure ɑ proton ved basen fra metanesulfonylklorid som danner en sulfen. Sulfen er veldig elektrofil og reagerer raskt med alkoholen:

Disse reaksjonene vil ofte bli vist med mekanismen vi så for tosylering i grunnkurs.
Spør din instruktør om den samme mekanismen som for tosylering er akseptabel for mesylering.
dannelsen av det reaktive sulfen-mellomproduktet gir en liten fordel for mesylat når man arbeider med tertiære alkoholer, siden De reagerer veldig sakte med TsCl.
fordelen med tosylering er at det er et større molekyl og gjør noe flytende alkohol til faste stoffer som noen ganger er foretrukket siden de er lettere å håndtere. Den aromatiske ringen av tosylatene gir også bedre visualisering på EN TLC-plate.
men igjen, det faktum at det er større gjør forberedelsen litt tregere, og det er ikke så reaktivt i substitusjonsreaksjoner også.
Triflate ion er også en utmerket forlatingsgruppe, men den er ikke dekket så mye i lærebøker, derfor vil vi ikke gå for mye inn i detaljer om de tilsvarende mekanismene.
konseptuelt er det imidlertid ingen forskjell – det vil bare bli forkortet Som Tf i stedet For Ts eller Ms, og du kan bare behandle det som en god forlatelsesgruppe når du arbeider med en øvelse.
Mesylater Og Tosylater I SN1-Reaksjoner
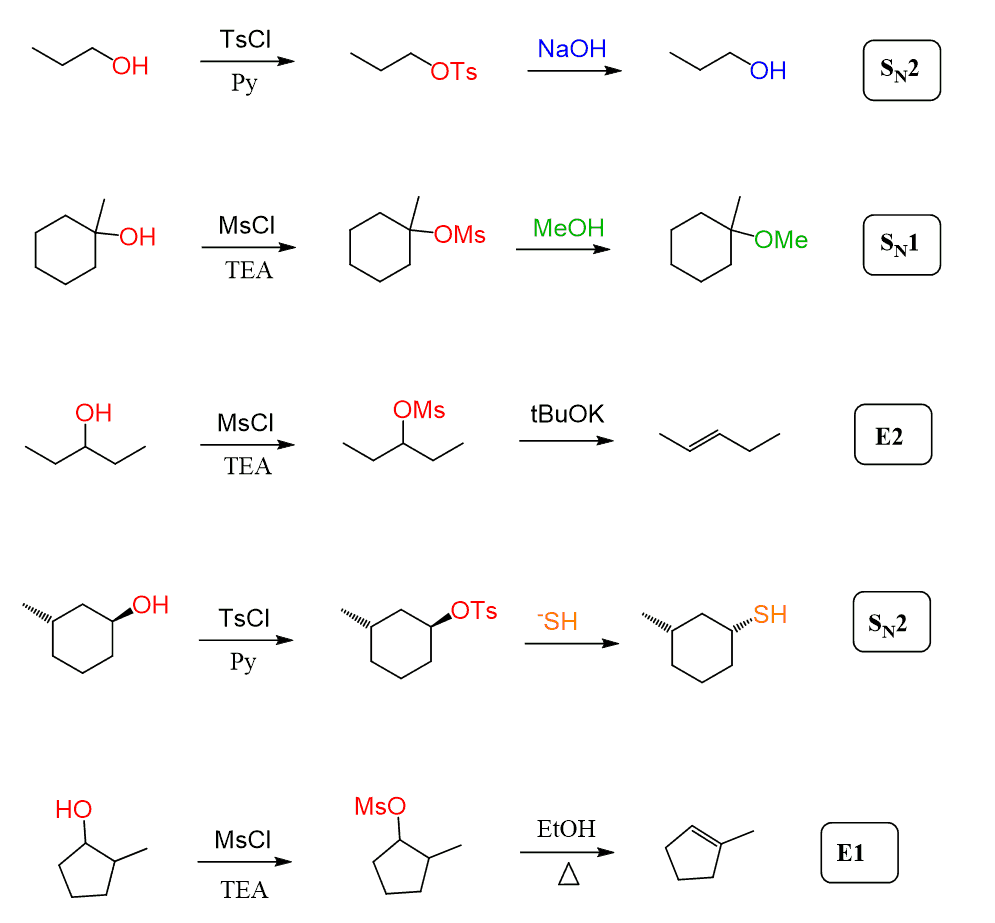
i alle eksemplene ovenfor har vi sett at tosylater og mesylater alltid reageres med sterke nukleofiler når de omdannes til alkylhalogenider, og I disse tilfellene VIL SN2-mekanismen dominere.
mesylater og tosylater kan imidlertid også gjennomgå sn1-og e1-eliminasjonsreaksjoner når en tertiær alkohol eller en svak nukleofil brukes:

generelt påvirker disse ikke prinsippene for å bestemme om reaksjonen går GJENNOM EN SN1, SN2, E1 eller E2 mekanisme.

Nukleofil Substitusjons – Og Elimineringspraksis Quiz
Ta Nå