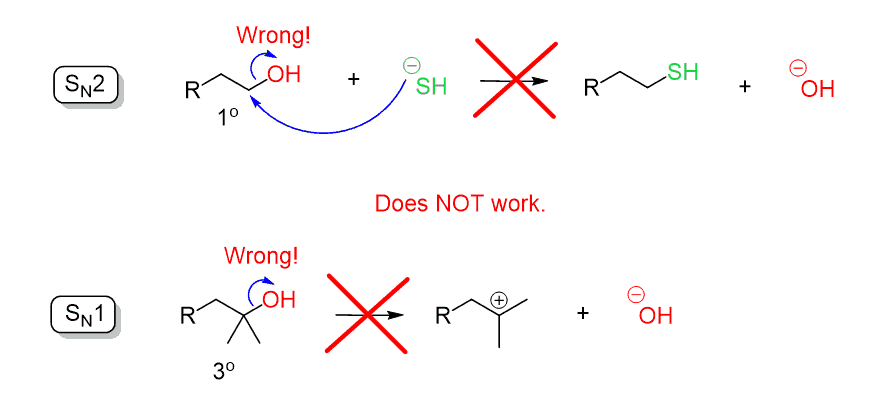
onthoud bij het bespreken van de substitutiereacties dat we zeiden dat het hydroxide–ion (- OH) een slechte vertrekgroep is omdat het een vrij sterke basis is. Daarom kan het OH niet worden uitgestoten door een directe nucleofiele aanval in een SN2-of SN1-reactie:
een manier om alcoholen in substitutiereacties om te zetten in alkylhalogeniden is door ze te reageren met sterke zuren zoals HCl, HBr en HI of door thionylchloride (SOCl2) of fosfor tribromide (PBr3) te gebruiken. In beide benaderingen was het principe achter deze transformatie de omzetting van de OH in een goed vertrekkende groep.

naast deze methoden kan het OH ook worden omgezet in een goede verlaat groep door te reageren met sulfonylchloriden zoals P-Tolueensulfonylchloride (TsCl), Methaansulfonylchloride (MsCl) en Trifluormethaansulfonylchloride (TfCl):

de resulterende producten worden Tosylaten (-OTs), Mesylaten (-OMs) en Triflaten (-OTf) genoemd, die allemaal uitstekende verlaat groepen zijn en kunnen worden gebruikt in substitutie-en eliminatiereacties:

de vraag is waarom we ons leven moeten compliceren en omgaan met tosylaten en mesylaten als de reactie met zuren prima werkt, toch?In het algemeen is het gebruik van alkylsulfonaten een beter alternatief voor HX-zuren om de stereochemie van de reactie te beheersen en het gebruik van sterke zuren te vermijden.
dus wat is precies gunstig voor de stereochemie van de reactie?
vergeet niet dat een probleem met het gebruik van zuren het mogelijke SN1-mechanisme is dat een carbocatie vormt en kan leiden tot verlies van stereochemie en herschikkingen voor bepaalde alcoholen:

in tegenstelling tot alcoholen, mesylaten en tosylaten worden altijd gereageerd met een zout zoals NaCl of NaBr en niet de zuren. Het gebruik van zouten is om ervoor te zorgen dat de halogenen in een vorm van goede nucleofielen als ze niet worden onderdrukt door de protonen en de reactie gaat door SN2 mechanisme. Het is niet nodig om een zuur te gebruiken omdat de OH al een goed vertrek is, wat een ander voordeel is omdat de reactie onder mildere omstandigheden wordt uitgevoerd.
vermeldenswaard is ook dat mesylaten en tosylaten niet alleen worden gebruikt voor de halogeenvorming van alcoholen. Ze zetten de OH eenvoudig om in een goede leaving group waarna ze kunnen deelnemen aan elke substitutie-en eliminatiereactie:
Oké, we hebben op dit punt het idee besproken om deze reagentia te gebruiken, maar hoe werken ze, wat is het mechanisme van mesylatie en tosylatie?
laten we dit één voor één behandelen:
laten we twee reacties vergelijken met een goed nucleofiel:

Hoe komt het dat de eerste reactie niet werkt terwijl de tweede heel mooi werkt? Waarom is de tosylate een betere vertrekgroep dan de OH?
als je je de resonantiestabilisatie herinnert, goed gedaan-dat is wat het is. Terwijl de zuurstof van de OH-groep de volledige negatieve lading op zichzelf draagt, heeft het sulfonaat-ion drie oxygens om de negatieve lading aan te kunnen die beter is dan de enige in de hydroxylgroep:

laten we het mechanisme bespreken voor het omzetten van (R)-2-Butanol naar een tosylaat gevolgd door een substitutie reactie via het SN2 mechanisme.
in de eerste stap werkt de alcohol als een nucleofiel dat de zwavel aanvalt om het chloride te vervangen.
merk op dat de koolstof met het stereogene centrum niet betrokken is bij deze stap en dat de configuratie ervan nog steeds behouden blijft:

pyridine wordt toegevoegd als basis om het tussenproduct te deprotoneren en het proces te versnellen om de tolueensulfonaatester (tosylate) te vormen.
na deze stap is de OH nu veranderd in een goede leaving group die eruit kan worden geschopt door een nucleofiel:

Mesylatie gaat door een iets ander mechanisme. De eerste stap hier is de deprotonatie van het zure ɑ-proton door de base van methaansulfonylchloride dat een sulfeen vormt. Het sulfeen is zeer elektrofiel en reageert snel met de alcohol:

deze reacties zullen vaak worden getoond met het mechanisme dat we zagen voor de tosylatie in bacheloropleidingen.
vraag uw instructeur of hetzelfde mechanisme als voor tosylatie aanvaardbaar is voor mesylatie.
de vorming van het reactieve sulfeen-tussenproduct geeft mesylaat een licht voordeel bij het werken met tertiaire alcoholen, omdat deze zeer langzaam reageren met TsCl.
het voordeel van tosylering is dat het een groter molecuul is en sommige vloeibare alcohol omzet in vaste stoffen die soms de voorkeur krijgen omdat ze gemakkelijker te hanteren zijn. Ook zorgt de aromatische ring van de tosylaten voor een betere visualisatie op een TLC-plaat.
maar nogmaals, het feit dat de stof groter is, maakt de bereiding ervan iets langzamer en is minder reactief bij substitutiereacties.Triflate ion is ook een uitstekende leaving group, echter, het is niet zo veel behandeld in undergraduate leerboeken, daarom zullen we niet te veel ingaan op de bijbehorende mechanismen.
echter, conceptueel is er geen verschil – het zal alleen worden afgekort als Tf in plaats van Ts of Ms en je kunt het gewoon behandelen als een goede leaving group wanneer je aan een oefening werkt.
Mesylaten en Tosylaten in SN1-reacties
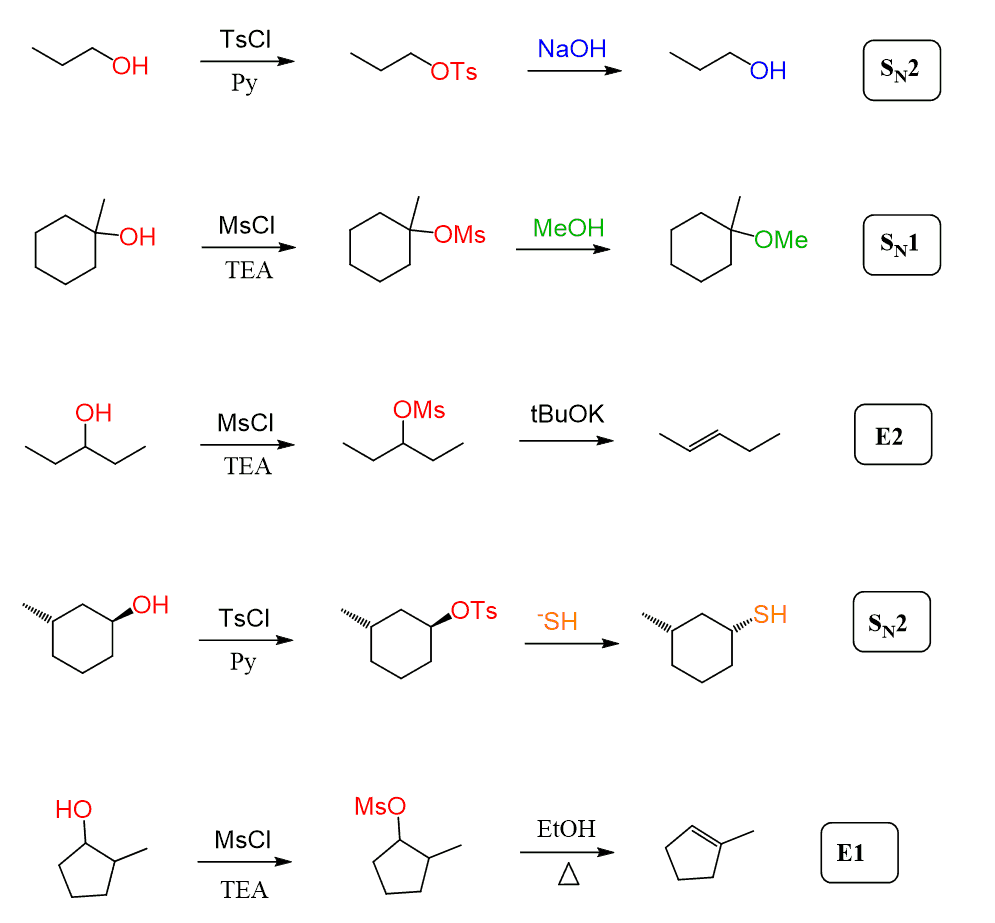
in alle bovenstaande voorbeelden hebben we gezien dat tosylaten en mesylaten altijd reageren met sterke nucleofielen wanneer ze worden omgezet in alkylhalogeniden en in deze gevallen zal het SN2-mechanisme overheersen.
mesylaten en tosylaten kunnen echter ook SN1-en E1-eliminatiereacties ondergaan wanneer een tertiair alcohol of een zwak nucleofiel wordt gebruikt:

in het algemeen hebben deze geen invloed op de principes om te bepalen of de reactie door een SN1 -, SN2 -, E1-of E2-mechanisme gaat.

nucleofiele substitutie – en Eliminatiepraktijkquiz
neem nu