継続的な医学教育
記事
慢性腎臓病の重要な合併症
I van der WaltI;C R SwanepoelII;B MahalaIII;A M MeyersIV
対応
要約
慢性腎臓病(ckd)の合併症は、脂質異常症高カリウム血症、代謝性アシドーシス、貧血、および骨およびミネラル障害である。 脂質異常症は低密度リポタンパク質低下剤で治療することができる。 スタチンは段階4および5CKDで非効果的ですが、より早い段階の病気の進行を防ぐために示されます。 慢性アシドーシスは、最近、CKD腎機能障害の進行の危険因子であることが示されている。 したがって、治療は必須です。 実際には、これは、ナトリウムレベルの上昇にもかかわらず血圧を上昇させない安価で安全な治療法である、1日あたり2-3回、重炭酸ナトリウムの1-2 ヘモグロビンの目標レベルは、国際的な指針に従って、10g/dLと12g/dLの間にあります。 血清リン酸レベルは、ステージ4CKD、特に冠動脈頸動脈および他の血管石灰化に関連し、虚血性心疾患、心筋梗塞および脳卒中を引き起こす可能性のあるステージ5ckdで上昇する。 副甲状腺ホルモンレベルの上昇(二次性副甲状腺機能亢進症)はまた、心血管疾患の主要な危険因子であり、高血圧の増加およびCKD関連貧血の治療への
脂質異常症
慢性腎臓病(CKD)は、リポタンパク質の構造と機能の変化に関連しています。:
- 高密度リポタンパク質コレステロールの減少
- 中密度リポタンパク質の増加
- プロサテロゲン脂質粒子の増加。
脂質異常症コントロールの意義
- 脂質異常症の治療に成功すると、心血管疾患(CVD)リスクが低下し、腎機能の低下も遅らせることが知られています。
- スタチンは尿中タンパク質またはアルブミン排泄を減少させることが示されているため、蛋白尿を伴うCKDに推奨されている。
- ステージ3-5CKDにおけるスタチンの使用に関する備考を表1に示します。
- スタチンとフィブラートの同時使用は横紋筋融解症のリスクを増加させる。
低密度リポタンパク質コレステロールの標的
- 腎臓疾患アウトカム品質イニシアチブ(KDOQI)ガイドラインでは、ckdにおける脂質異常症治療にLDL-C>3.5mmol/Lの場合、食事療法、体重管理、運動などのライフスタイルの変更に加えて、薬物療法を検討する必要があります。
- LDL-Cを<1.8mmol/Lに低下させることが不可欠です。
CKD患者におけるコレステロール低下のためのKDOQIガイドライン(2013):
- 患者>50歳はスタチンを受けるべきである。
- 18-49歳の患者は、別の併存疾患がある場合にスタチンを投与すべきである。
- 腎臓移植の受信者はスタチンを受け取るべきです。
高カリウム血症と代謝性アシドーシスの治療
高カリウム血症
- ckdが段階的に進行するにつれて、アシドーシスと高カリウム血症が観察される。 高カリウム血症は、血清カリウムレベル>5.5mmol/Lとして定義されています.高カリウム血症>7mmol/Lは、心停止を引き起こす可能性があります;そのような場合は、緊急事態として扱われるべきです.
- 腎機能が低下していないにもかかわらず、重度の高カリウム血症が観察される場合は、血液検体の溶血によるアーティファクトである偽高カリウム血症を考慮すべきである。
- 高カリウム血症は不整脈の危険因子である。 重度の高カリウム血症の場合、緊急レベルは、tenting T波、PQ時間の延長、P波の消失およびQRS複合体の拡大などのECG異常によって確認されるべきである。 生命を脅かすECG所見、徐脈および低血圧を有する患者は、速やかに治療し、続いて腎科医と併用して治療するべきである。
- CKDにおける薬物誘発性高カリウム血症は、主にACE阻害剤、アンジオテンシンII受容体遮断薬(ARBs)およびスピロノラクトンなどのレニン-アンジオテンシン-アルドステロン阻害剤またはカリウム含有食品の過剰摂取によって引き起こされる。 他の原因には、β遮断薬、ジゴキシン、非ステロイド性抗炎症薬(Nsaid)、トリメトプリムまたはペンタミジンの投与が含まれる。
- 糖尿病性腎症によって引き起こされるCKDは、比較的よく保存された腎機能にもかかわらず高カロリー血症を引き起こす可能性があるハイポレニン血症低アルドステロン症と関連している可能性がある。 これは、IV型尿細管性アシドーシスとして知られている。
緊急治療
- 最初のステップは心筋を安定させることです。 グルコン酸カルシウムの静脈内投与は血漿カリウムを変化させないが、一時的にECGを改善する。 グルコン酸カルシウム20mLの静脈内投与は、3-5分以内にECGに改善がなければ、1分以上繰り返すことができる。
- 第二のステップは、カリウムを細胞外から細胞内コンパートメントにシフトさせ、血清カリウムレベルを急速に低下させることである。
- 低血糖を防ぐために5%の右旋糖の静脈内の注入に先行している膠灰粘土として50%の右旋糖の50mLと結合される10Uの短時間作用型のインシュリンを
- β2-アゴニスト。 20mgのサルブタモール、β2アゴニストを、10分にわたる吸入によって、行為の開始のおよそ30分投与して下さい。 (これは通常必須ではありません。)
- まだ透析を受けていないCKD患者の重炭酸ナトリウム。 重炭酸塩の管理は腎臓のカリウムの排泄物を高めることによって血清のカリウムを下げることができます。 患者が重炭酸塩の処置を必要とする厳しい新陳代謝のアシドーシスを持たなければ効果は激しい状態の使用非常に遅く、ないです。
- 以前の一時的な措置が行われると、体内からカリウムを除去するためのさらなる介入が行われます。
- ループ利尿薬は、適切な腎機能を有する患者でのみ成功する。
- 樹脂交換体のポリスチレンスルホン酸ナトリウム(ケキセル酸)は、同量のナトリウムと引き換えに血液から腸内にカリウムを除去する。 それは遅い機能であり、血しょうカリウムは1-2時間以内に減少し始めますだけ。 それは経口的にまたは保持浣腸として与えることができる。 与えられた量は30gから60gまで変化する。 これは繰り返すことができますが、便秘を引き起こす傾向があります。
- 血液透析は、進行したCKDおよび重度の高カリウム血症の患者に選択される治療法である。
予防
- カリウム制限に関する食事カウンセリング。
- カリウムの腎排泄を妨げる薬物、例えばカリウム温存利尿薬、Nsaid、ACE阻害薬、ARBsを避けてください。
- 非選択的β遮断薬など、細胞内から細胞外コンパートメントへのカリウムシフトを妨げる薬物を避けてください。
- 腎機能が十分に残存している選択された患者では、ループ利尿薬による治療を使用して尿中カリウム排泄を刺激することができる。
代謝性アシドーシス
代謝性アシドーシスの特徴は次のとおりです:
- 低動脈血pH(acidaemia) (<7.35)
- 血清HCO3濃度の低下
- PCO2の低下(呼吸補償による)。
全身作用
代謝性アシドーシスは、組織や器官に様々な変化をもたらす可能性があります。:
- 頻脈、徐脈、低血圧、心不全などの心臓血管の変化
- 生命を脅かす高カリウム血症
- 吐き気、嘔吐、腹痛
- 中枢神経系のうつ病を伴う混乱。
関連する症状および徴候は、pHの低下の速度および大きさ、および根底にある病理に依存する。
関連する症状および徴候は、pHの低下の速度および大きさおよび根底にある病理に依存する。
尿毒症性アシドーシス
代謝性アシドーシスは、h+を排泄する能力の低下またはアンモニアを産生することができないために腎不全で起こる。
CKDの初期段階(GFR<40mL/分)では、正常なアニオンギャップ(AG)を伴う代謝性アシドーシスが明らかになることがある。 CKDが進行すると(GFR<20mL/分)、高いAG代謝性アシドーシスが生じることがある。
高度なCKDでは、硫酸塩、リン酸塩、尿酸塩、ヒプラ酸塩などの保持された酸が存在するため、AGの増加が典型的です。
治療の原則
代謝性アシドーシスの患者はしばしば非常に病気であり、その状態は急速に悪化する傾向があります。
重炭酸ナトリウムの日常的な投与は議論の余地があるが、重度のアシドーシスを矯正するために行う必要がある。
重炭酸ナトリウム投与の潜在的な合併症には、特に腎機能または心機能障害、高ナトリウム血症、低カリウム血症、低カルシウム血症およびアルカロー
必要な重炭酸塩の量(mmol)は次のように推定することができます。
目標血漿HCO3-(mmol/L)-現在の血漿HCO3-(mmol/L)x40%体重(kg)。
Ckdにおける貧血
貧血はCKDの最も一般的な合併症であり、生活の質の大幅な低下に関連しています。 腎疾患における貧血の治療の成功は、腎機能の低下を減少させる可能性がある。 ターゲットヘモグロビンのレベルはckdの貧血症を扱うとき10-12g/dLです。 処置は高価であり、従って理性的な考察は必須である。
腎性貧血
腎性貧血は典型的には正常染色性の正常細胞性である。 それは腎臓と部分的にuraemic毒素によってエリスロポエチンの損なわれた生産によって主に引き起こされます。 Ckd、特に透析患者で役割を果たす可能性のある他の原因は次のとおりです:
- エリスロポエチン耐性(最も有意)
- 骨髄毒素(まだ単離されていない)
- 副甲状腺機能亢進症に続発する骨髄線維症
- 進行中の炎症過程、例えば 未処理の感染
- ヘマチン欠乏(鉄、葉酸およびビタミンB12)
- 赤血球破壊の増加
- 異常な赤血球膜、浸透圧脆弱性の増加
- オカルト消化管出血および採血および血液透析中の失血の増加
- ACE阻害。
エリスロポエチンは、骨髄の初期の赤血球前駆細胞に位置するエリスロポエチン受容体に結合することによって赤血球産生を刺激する糖タンパク質ホルモンである。
これらの前駆細胞へのエリスロポエチンの結合は、アポトーシスからそれらを保存し、したがって、赤血球への細胞分裂および成熟を可能にする。 CKDでは、エリスロポエチンのレベルは貧血症のある程度のために正常、不十分かもしれません。 罹患した腎臓におけるエリスロポエチン産生を損なうメカニズムはあまり理解されていない。 Uraemic阻害剤による赤血球生成の阻害も可能であり、CKDの貧血に大きく寄与する可能性がある;そのような因子は同定されていない。 透析はエリスロポエチン刺激的な代理店の腎臓の貧血症そして効力を改善できます。 腎疾患を有する患者は、慢性感染症および他の慢性疾患を発症する可能性がある。 慢性疾患は、このような場合に貧血に寄与する。 慢性疾患の貧血はエリスロポエチンの生産および効力および減らされた鉄供給の阻止による炎症性cytokinesによって仲介されます。
ヘプシジンは鉄代謝の重要なメディエーターである。 炎症状態でhepcidinは腸の鉄の吸収を妨げ、大食細胞の鉄の隔離を促進します。
その他の原因
ckdに伴う貧血は腎性貧血である可能性が最も高い; ただし、他の病気のための差動は段階1-3CKDのために本当考慮されなければなりません。
CKD患者における貧血の評価には、赤血球指数(平均小体ヘモグロビン濃度、平均小体体積)を有する完全な血球数を含める必要があります。 腎性貧血は、通常、正常色素性および正常細胞性である。 ビタミンB12およびfolateの不足はヘモグロビンの鉄の不足か受継がれた無秩序はmicrocytosisを作り出すかもしれないがmacrocytosisの原因となるかもしれません。 組織貯蔵中の鉄のレベルまたは赤血球生成のための鉄供給の妥当性を評価するために、鉄試験を実施すべきである。
貧血は、栄養失調または全身性疾患の存在を意味する可能性があります。 それは入院、CVDおよび死亡率のための独立した危険率です。 ACE阻害剤は貧血を悪化させる可能性があります。
貧血の治療は心臓を保護します
貧血は心不全を悪化させます。 貧血の治療は平均余命に有益であり、CVDの予後を改善することもできる。 生活環境基準はターゲット範囲内のヘモグロビンのレベルとのそれらのために改善されます。
ヘモグロビンの目標レベル
腎臓病改善グローバルアウトカム(KDIGO)ガイドラインでは、透析中のCKD患者におけるヘモグロビンレベルは10.0g/dLから12g/dLの範囲でなければならないと述べている。 透析前のレベルは10g/dLであるべきです。
腎科医とプライマリケア医の間の役割分担
腎科医への早期紹介をお勧めします。 治療戦略が決定されると、腎科医とプライマリケア医はパートナーシップで管理を継続します。
鉄欠乏症の評価
鉄欠乏症の評価と正しい鉄供給は貧血の治療において重要である。 貧血症は患者が明らかに不十分な鉄ではない時でさえ鉄の補足の管理と組換えのエリスロポエチンの使用により相対的な鉄の不足を引き起こす
CKDにおける組換えヒトエリスロポエチンのKDOQIガイドラインは次のとおりです:
- 血清フェリチン>透析前100ng/mL
- 血清フェリチン>200ng/mL透析患者
- トランスフェリン飽和>20%。
鉄は静脈内または経口で投与することができます。 静脈内の鉄はエリスロポエチンの処置の透析の患者そしてそれらのためにより効果があります、特に。
外因性エリスロポエチンの使用
現在、エリスロポエチン刺激剤が多数あり、古い短作用薬や新しい長作用薬が含まれています。 適切な薬剤および用量は、費用、有効性および利便性を含む多くの要因に依存する。 これらの薬剤は高価で副作用があるため、その管理は腎臓専門医に任せるのが最善です。
骨およびミネラル障害
高リン酸血症は、代謝事象のカスケードを引き起こし、CKDの骨ミネラル密度をもたらす重要な異常である。
リン酸は腎機能が低下すると保持され、クレアチニンが保持されるのとほぼ同じです。 この保持は段階3b CKDが達されると同時に明らかになります。 それは最終段階が近づくと徐々に悪化し、正常な限界の内でに下げられなければなりません。
高リン酸食は、骨細胞を刺激して線維芽細胞成長因子23を産生し、これはビタミンDの活性型ビタミンD3へのヒドロキシル化を阻害する。 ビタミンD3がなければ、カルシウム吸収および骨の改造は減ります。 結果として生じるhypocalcaemiaは腎臓の骨の病気の必然的な開発を用いる副甲状腺のホルモン(PTH)解放のための主要な刺激、です。 血清アルカリホスファターゼは増加した骨の回転のマーカーです。 従って、高い血レベルはPTHの活動を示します。
注目すべきは、高リン酸血症とビタミンD3欠乏症の両方がPTH分泌を増加させることである。
当初、PTH分泌の刺激は、血清カルシウムを増加させ、血液中のリン酸レベルを低下させ、ビタミンD3を処方することによって制御することができる。 これは二次性副甲状腺機能亢進症の段階である(表2)。 しかし、時間と制御されていない、PTH分泌の長期刺激により、副甲状腺ホルモンは自律的になり、自律性副甲状腺機能亢進症の段階に達する(表3)。 副甲状腺摘出術は今必要かもしれませんまたは無秩序な新陳代謝の環境を元通りにすることを試みるために高いcalcimimetic薬剤は管理されなければな


ビタミンD3レベル測定の解釈については不確実性があります。 それらを測定する場合は、25-OH-ビタミンD3レベルを評価することをお勧めします。
治療
治療の手順を表4に示します。 非カルシウム含有リン酸結合剤は、有意な転移性石灰化がある場合および/または高カルシウム血症が存在する場合に推奨される。
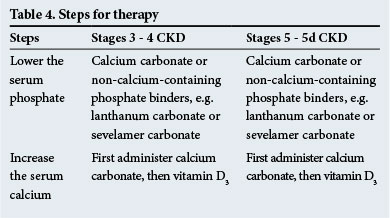
副甲状腺を血清カルシウムに感受性にするカルシミメティクスは、血清PTHレベルが高い場合(正常範囲より2-9倍-正常範囲については実験室に確認)、副甲状腺機能亢進症で処方するのに有用である。 それらは、CKDで起こる臨床状況のいずれかにおいて、PTHレベルの低下において果たすべき役割を有する。
フォローアップ血液測定
これらを表5に示す。
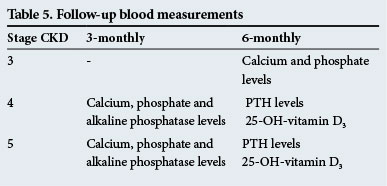
これらのフォローアップの時間は指針だけであり、重要な異常があればテストはより頻繁に行われるべきです。
注意すべき特別なポイント
- ckdの過程の早い段階で腎臓科医を関与させます。
- 副甲状腺の過剰な抑制は避け、これは動的な骨疾患につながる。
- 二次性および自律性副甲状腺機能亢進症が診断される正確なPTHレベルは、様々なアッセイのために不確実である。 (骨のx線写真とともに)上で輪郭を描かれるように、生物化学は診断で助けるのにそれから使用されなければなりません。
- 血清アルカリホスファターゼレベルの傾向に注意してください。
- 骨粗鬆症は、CKDで発生する骨疾患に付随する。 Bisphosphonatesは段階3-5CKDの患者で使用されてはなりません。