educație medicală continuă
articol
complicații importante ale bolii renale cronice
i van der WaltI; C R SwanepoelII; B Mahalaii; A M MeyersIV
corespondență
rezumat
complicațiile bolii renale cronice (IRC) sunt dislipidemia hiperkaliemia, acidoza metabolică, anemia și tulburările osoase și minerale. Dislipidemia poate fi tratată cu medicamente care scad lipoproteinele cu densitate mică. Statinele sunt ineficiente în stadiile 4 și 5 CKD, dar sunt indicate pentru prevenirea progresiei bolii în stadiile anterioare. Acidoza cronică s-a dovedit recent a fi un factor de risc în progresia disfuncției renale CKD. Prin urmare, tratamentul este obligatoriu. Practic, aceasta ar trebui să constea din 1 – 2 lingurițe de bicarbonat de sodiu de 2-3 ori pe zi, care este o terapie ieftină și sigură, care nu crește tensiunea arterială în ciuda nivelului crescut de sodiu. Nivelurile țintă ale hemoglobinei, conform ghidurilor internaționale, sunt cuprinse între 10 g/dL și 12 g/dl. Concentrația plasmatică a fosfatului este crescută în IRC în stadiul 4 și, în special, în IRC în stadiul 5, care este asociată cu carotide coronariene și alte calcificări vasculare și poate duce la boli cardiace ischemice, infarct miocardic și accident vascular cerebral. Un nivel crescut al hormonului paratiroidian (hiperparatiroidismul secundar) este, de asemenea, un factor de risc major pentru bolile cardiovasculare și este asociat cu creșterea hipertensiunii arteriale și a rezistenței la tratamentul anemiei asociate cu IRC.
dislipidemia
boala renală cronică (IRC) este asociată cu modificări ale structurii și funcției lipoproteinelor, incluzând:
- reducerea colesterolului lipoproteinelor cu densitate mare
- creșterea lipoproteinelor cu densitate intermediară
- creșterea particulelor lipidice proatherogene.
semnificația controlului dislipidemiei
- se știe că tratamentul cu succes al dislipidemiei reduce riscul bolilor cardiovasculare (BCV) și ar trebui, de asemenea, să întârzie declinul funcției renale.
- deoarece s-a demonstrat că statinele scad excreția urinară de proteine sau albumină, acestea sunt recomandate pentru CKD cu proteinurie.
- observații privind utilizarea statinei în stadiile 3 – 5 CKD sunt prezentate în tabelul 1.
- utilizarea concomitentă de statine și fibrați crește riscul de rabdomioliză.
țintă pentru colesterolul cu lipoproteine cu densitate mică
- orientările Inițiativei privind calitatea rezultatelor bolii renale (KDOQI) recomandă următoarele pentru terapia cu dislipidemie în IRC: în cazurile de colesterol cu lipoproteine cu densitate mică (LDL-C) <3.5 mmol/L, primul pas este modificarea stilului de viață; în cazurile de LDL-C >3,5 mmol / l, terapia medicamentoasă trebuie avută în vedere pe lângă modificarea stilului de viață, inclusiv terapia dietetică, controlul greutății și exercițiile fizice.
- este esențial ca LDL-C să fie redus la <1, 8 mmol/L.
liniile directoare KDOQI pentru scăderea colesterolului la pacienții cu IRC(2013):
- pacienții cu vârsta >50 ani trebuie să primească o statină.
- pacienții cu vârsta cuprinsă între 18 și 49 de ani trebuie să primească o statină dacă există o altă comorbiditate.
- pacienții cu transplant renal trebuie să primească o statină.
tratamentul hiperkaliemiei și acidozei metabolice
hiperkaliemie
- pe măsură ce IRC progresează în stadiu, se observă acidoză și hiperkaliemie. Hiperkaliemia este definită ca o valoare a potasiului seric >5, 5 mmol/L. hiperkaliemia >7 mmol/l poate provoca stop cardiac; astfel de cazuri trebuie tratate ca urgențe.
- dacă se observă hiperkaliemie severă, în ciuda absenței funcției renale reduse, trebuie luată în considerare pseudohiperkaliemia, un artefact datorat hemolizei probei de sânge.
- hiperkaliemia este un factor de risc pentru aritmii. În cazurile de hiperkaliemie severă, nivelurile de urgență trebuie confirmate prin anomalii ECG, cum ar fi tentarea undelor T, prelungirea timpilor PQ, urmată de dispariția undei P și lărgirea complexului QRS. Pacienții cu constatări ECG care pun viața în pericol, bradicardie și hipotensiune arterială trebuie tratați prompt, urmat de tratament în asociere cu un nefrolog.
- hiperkaliemia indusă de medicament în IRC este cauzată în cea mai mare parte de inhibitorii renină-angiotensină-aldosteron, cum sunt inhibitorii ECA, blocanții receptorilor angiotensinei II (Bra) și spironolactonă sau de aportul excesiv de alimente care conțin potasiu. Alte cauze includ administrarea de blocante de blocante, digoxină, medicamente antiinflamatoare nesteroidiene (AINS), trimetoprim sau pentamidină.
- IRC cauzată de nefropatia diabetică poate fi asociată cu hipoaldosteronismul hiporeninemic, care poate determina hiperkaliemie în ciuda funcției renale relativ bine conservate. Aceasta este cunoscută sub numele de acidoză tubulară renală de tip IV.
tratament de urgență
- primul pas este stabilizarea miocardului. Administrarea intravenoasă a gluconatului de calciu nu modifică potasiul plasmatic, dar îmbunătățește tranzitoriu ECG. Administrarea de gluconat de calciu 20 mL intravenos timp de 1 minut poate fi repetată dacă nu există o îmbunătățire a ECG în decurs de 3 – 5 minute.
- a doua etapă este trecerea potasiului din compartimentul extracelular în cel intracelular pentru a încerca să scadă rapid nivelul potasiului seric. Acest lucru se poate face în trei moduri diferite:
- insulină intravenoasă combinată cu glucoză. Administrați 10 u insulină cu acțiune scurtă combinată cu 50 mL dextroză 50% sub formă de bolus, urmată de o perfuzie intravenoasă cu dextroză 5% pentru a preveni hipoglicemia.
- -agonist de la numărul 2. Administrați 20 mg salbutamol, un agonist de tip xc2, prin inhalare timp de 10 minute, cu debutul acțiunii aproximativ 30 de minute. (Acest lucru nu este de obicei necesar.)
- bicarbonat de sodiu la pacienții cu IRC care nu sunt încă dializați. Administrarea bicarbonatului poate reduce potasiul seric prin creșterea excreției renale de potasiu. Efectul este foarte lent și nu este utilizat într-o situație acută, cu excepția cazului în care pacientul are acidoză metabolică severă care necesită tratament cu bicarbonat.
- odată ce măsurile temporare anterioare au fost efectuate, sunt întreprinse intervenții suplimentare pentru eliminarea potasiului din organism.
- diureticele de ansă au succes numai la pacienții cu funcție renală adecvată.
- schimbătorul de rășină sulfonat de polistiren de sodiu (Kexelat) elimină potasiul din sânge în intestin în schimbul unei cantități egale de sodiu. Acționează lent și potasiul plasmatic începe să scadă numai în decurs de 1 – 2 ore. Poate fi administrat oral sau ca o clismă de retenție. Cantitatea dată variază de la 30 g la 60 g. Acest lucru poate fi repetat, dar tinde să provoace constipație.
- hemodializa este tratamentul preferat pentru pacienții cu IRC în stadiu avansat și hiperkaliemie severă.
prevenție
- consiliere dietetică privind restricția de potasiu.
- evitați medicamentele care interferează cu excreția renală a potasiului, de exemplu diuretice care economisesc potasiu, AINS, inhibitori ECA, Bra.
- evitați medicamentele care interferează cu trecerea potasiului de la compartimentele intracelulare la cele extracelulare, de exemplu, blocante neselective ale receptorilor de azot.
- la pacienții selectați cu funcție renală reziduală suficientă, tratamentul cu un diuretic de ansă poate fi utilizat pentru a stimula excreția urinară de potasiu.
acidoza metabolică
acidoza metabolică se caracterizează prin:
- pH arterial scăzut în sânge (acidemie) (<7.35)
- reducerea concentrației serice de HCO3
- scăderea pCO2 (din compensarea respiratorie).
efecte sistemice
acidoza metabolică poate duce la o varietate de modificări ale țesuturilor și organelor, de ex.:
- modificări cardiovasculare cum sunt tahicardie, bradicardie, hipotensiune arterială și insuficiență cardiacă
- hiperkaliemie care pune viața în pericol
- greață, vărsături și dureri abdominale
- confuzie, cu depresie a sistemului nervos central.
simptomele și semnele asociate vor depinde de rata și amploarea scăderii pH-ului și a patologiei subiacente.
acidoza uremică
acidoza metabolică apare în insuficiența renală datorită capacității scăzute de a excreta H+ sau incapacității de a produce amoniac.
în stadiile incipiente ale CKD (RFG < 40 mL/min), acidoza metabolică cu un decalaj anionic normal (AG) poate deveni evidentă. Pe măsură ce CKD progresează (RFG <20 mL/min), poate rezulta o acidoză metabolică AG ridicată.
în CKD avansat, un AG crescut este tipic datorită prezenței acizilor reținuți, cum ar fi sulfații, fosfații, urații și hipuratul.
principii de tratament
pacienții cu acidoză metabolică sunt adesea foarte bolnavi și starea lor tinde să se deterioreze rapid.
administrarea de rutină a bicarbonatului de sodiu este controversată, deși trebuie făcută pentru a corecta acidoza severă.
complicațiile potențiale ale administrării bicarbonatului de sodiu includ supraîncărcarea volumului, în special la pacienții cu insuficiență renală sau cardiacă, hipernatremie, hipokaliemie, hipocalcemie și alcaloză.
cantitatea de bicarbonat necesară (mmol) poate fi estimată după cum urmează:
plasmă țintă HCO3- (mmol/L) – plasmă curentă HCO3- (mmol/L) x 40% greutate corporală (kg).
anemie în IRC
anemia este cea mai frecventă complicație a IRC și este asociată cu scăderea semnificativă a calității vieții. Tratamentul cu succes al anemiei în boala renală poate reduce declinul funcției renale. Valorile țintă ale hemoglobinei sunt de 10 – 12 g/dL atunci când se tratează anemia în IRC. Tratamentul este costisitor și, prin urmare, considerația rațională este obligatorie.
anemie renală
anemia renală este de obicei normocitară normocromă. Este cauzată în principal de afectarea producției de eritropoietină de către rinichi și parțial de toxine uremice. Alte cauze care pot juca un rol în CKD, în special la pacienții dializați, sunt:
- rezistența la eritropoetină (cea mai semnificativă)
- toxine ale măduvei osoase (niciuna nu a fost încă izolată)
- fibroza măduvei osoase, secundară hiperparatiroidismului
- procese inflamatorii în desfășurare, de exemplu. infecții netratate
- deficit hematinic (fier, folat și vitamina B12)
- creșterea distrugerii celulelor roșii
- anomalii ale membranelor celulelor roșii, determinând creșterea fragilității osmotice
- creșterea pierderilor de sânge din hemoragiile gastrointestinale oculte și prelevarea de probe de sânge și în timpul hemodializei
- inhibarea ECA.
eritropoietina este un hormon glicoproteic care stimulează producția de celule roșii prin legarea de receptorii eritropoietinei, localizați pe celulele progenitoare eritroide timpurii din măduva osoasă.
legarea eritropoietinei de aceste celule progenitoare le salvează de apoptoză și, prin urmare, permite diviziunea celulară și maturarea în celule roșii. În IRC, concentrațiile de eritropoietină pot fi normale, dar inadecvate pentru gradul de anemie. Mecanismele care afectează producția de eritropoietină în rinichii bolnavi rămân puțin înțelese. De asemenea, este posibilă inhibarea eritropoiezei de către inhibitorii uremici și poate contribui în mare măsură la anemia IRC; acești factori nu au fost identificați. Dializa poate îmbunătăți anemia renală și eficacitatea medicamentelor care stimulează eritropoietina. Pacienții cu boală renală pot dezvolta infecții cronice și alte boli cronice. Boala cronică contribuie la anemie în astfel de cazuri. Anemia bolii cronice este mediată de citokine inflamatorii prin inhibarea producției și eficacității eritropoietinei și reducerea disponibilității fierului.
Hepcidina este mediatorul cheie al metabolismului fierului. În stările inflamatorii, hepcidina blochează absorbția fierului în intestin și promovează sechestrarea fierului în macrofage.
alte cauze
anemia asociată cu IRC este cel mai probabil anemie renală; cu toate acestea, diferențialul pentru alte boli trebuie considerat adevărat pentru etapele 1 – 3 CKD.
evaluarea anemiei la pacienții cu IRC trebuie să includă o hemogramă completă cu indicii eritrocitelor (concentrația medie a hemoglobinei corpusculare, volumul mediu corpuscular). Anemia renală este de obicei normocromă și normocitară. Deficitul de vitamina B12 și acid folic poate duce la macrocitoză, în timp ce deficitul de fier sau tulburările moștenite ale hemoglobinei pot produce microcitoză. Trebuie efectuate studii privind fierul pentru a evalua nivelul de fier din depozitele de țesuturi sau adecvarea aportului de fier pentru eritropoieză.
anemia poate semnifica prezența malnutriției sau a bolilor sistemice. Este un factor de risc independent pentru spitalizare, BCV și mortalitate. Inhibitorii ECA pot exacerba anemia.
tratamentul anemiei protejează inima
anemia exacerbează insuficiența cardiacă. Tratamentul anemiei este benefic pentru speranța de viață și poate îmbunătăți, de asemenea, prognosticul BCV. Calitatea vieții este îmbunătățită pentru cei cu un nivel al hemoglobinei în intervalul țintă.
valori țintă ale hemoglobinei
ghidurile privind îmbunătățirea rezultatelor globale ale bolii renale (KDIGO) prevăd că valorile hemoglobinei trebuie să varieze între 10, 0 g/dL și 12 g/dL la pacienții cu IRC dializați. Nivelurile de Pre-dializă trebuie să fie de 10 g/dl.
partajarea rolului între nefrologi și medicii de îngrijire primară
se recomandă trimiterea timpurie la un nefrolog. Odată ce strategia de tratament a fost decisă, nefrologii și medicii de îngrijire primară continuă managementul în parteneriat.
evaluarea deficitului de fier
evaluarea deficitului de fier și a aportului corect de fier este importantă în tratamentul anemiei. Anemia se poate ameliora odată cu administrarea suplimentelor cu fier, chiar și atunci când pacientul nu prezintă aparent deficit de fier, deoarece utilizarea eritropoetinei recombinante poate determina deficit relativ de fier.
ghidurile KDOQI pentru eritropoetina umană recombinantă în IRC sunt:
- feritină serică > 100 ng/mL înainte de dializă
- feritină serică > 200 ng/mL la pacienții dializați
- saturația transferinei > 20%.
fierul poate fi administrat intravenos sau oral. Fierul intravenos este mai eficace, în special pentru pacienții dializați și cei tratați cu eritropoietină.
utilizarea eritropoietinelor exogene
în prezent există un număr de agenți de stimulare a eritropoietinei disponibili, inclusiv medicamente mai vechi, cu acțiune mai scurtă și medicamente noi, cu acțiune mai lungă. Agentul și doza corespunzătoare depind de o serie de factori, inclusiv costul, eficacitatea și comoditatea. Deoarece aceste medicamente sunt scumpe și au efecte secundare, gestionarea lor este cel mai bine lăsată la un nefrolog.
tulburări osoase și minerale
hiperfosfatemia este anomalia cheie care declanșează o cascadă de evenimente metabolice, rezultând densitatea minerală osoasă a CKD.
fosfatul este reținut pe măsură ce funcția renală se deteriorează – la fel ca creatinina este reținută. Această retenție devine evidentă pe măsură ce se atinge stadiul 3B CKD. Se va agrava progresiv pe măsură ce stadiul final este abordat și trebuie redus în limite normale.
o dietă bogată în fosfat stimulează osteocitele să producă factorul de creștere fibroblast 23 care, la rândul său, inhibă hidroxilarea vitaminei D la 1,25 vitamina D activă.3. Fără vitamina D3, absorbția calciului și remodelarea osoasă sunt scăzute. Hipocalcemia rezultată este un stimul major pentru eliberarea hormonului paratiroidian (PTH), cu dezvoltarea ulterioară a bolii osoase renale. Fosfataza alcalină serică este un marker al turnover-ului osos crescut. Prin urmare, nivelurile ridicate de sânge arată activitate PTH.
de remarcat, atât hiperfosfatemia, cât și deficitul de vitamina D3 duc la creșterea secreției de PTH.
inițial stimulul pentru secreția de PTH poate fi controlat prin creșterea calciului seric, reducerea concentrațiilor de fosfat din sânge și prescrierea vitaminei D3. Aceasta este etapa hiperparatiroidismului secundar (Tabelul 2). Cu toate acestea, cu timpul și stimularea necontrolată, prelungită a secreției de PTH, hormonii paratiroidieni devin autonomi și se atinge stadiul hiperparatiroidismului autonom (Tabelul 3). Paratiroidectomia poate fi acum necesară sau trebuie administrate medicamente calcimimetice scumpe pentru a încerca să restabilească mediul metabolic dezordonat.


există incertitudine cu privire la interpretarea măsurătorilor nivelului de vitamina D3. Dacă trebuie măsurate, atunci se recomandă evaluarea nivelurilor de 25-OH-vitamina D3.
terapie
etapele tratamentului sunt prezentate în tabelul 4. Lianții fosfați care nu conțin calciu sunt recomandați atunci când există calcificări metastatice semnificative și/sau când este prezentă hipercalcemie.
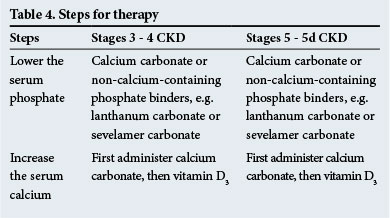
Calcimimeticele, care sensibilizează glandele paratiroide la calciul seric, sunt utile pentru a prescrie în hiperparatiroidism atunci când nivelurile serice de PTH sunt ridicate (de 2 – 9 ori peste intervalul normal – verificați cu laboratorul pentru intervale normale). Acestea au un rol de jucat în diminuarea nivelurilor de PTH în oricare dintre situațiile clinice care apar în CKD.
măsurători de sânge de urmărire
acestea sunt prezentate în tabelul 5.
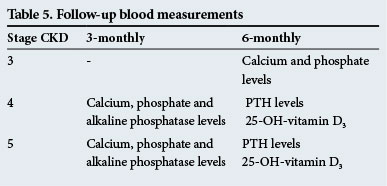
aceste perioade de urmărire sunt doar orientări, iar testele trebuie efectuate mai frecvent dacă există anomalii semnificative.
puncte speciale de notat
- implică un nefrolog la începutul cursului CKD.
- evitați supresia glandelor paratiroide, deoarece aceasta va duce la o boală osoasă dinamică.
- nivelul exact al PTH la care este diagnosticat hiperparatiroidismul secundar și autonom este incert, din cauza diferitelor teste. Biochimia, așa cum s-a subliniat mai sus (împreună cu radiografiile oaselor), trebuie apoi utilizată pentru a ajuta la diagnostic.
- fiți conștienți de tendințele nivelurilor serice de fosfatază alcalină; nivelul poate fi în intervalul normal, dar poate să se fi dublat față de citirea anterioară.
- osteoporoza însoțește boala osoasă care apare în CKD. Bifosfonații nu trebuie utilizați la pacienții cu IRC în stadiile 3 – 5.