FORMATION MÉDICALE CONTINUE
ARTICLE
Complications importantes de la maladie rénale chronique
I van der WaltI; C R SwanepoelII; B MahalaIII; A M MeyersIV
Correspondance
RÉSUMÉ
Les complications de l’insuffisance rénale chronique (IRC) sont la dyslipidémie, l’hyperkaliémie, l’acidose métabolique, l’anémie et les troubles osseux et minéraux. La dyslipidémie peut être traitée par des hypolipoprotéines de basse densité. Les statines sont inefficaces aux stades 4 et 5 de l’IRC, mais sont indiquées pour prévenir la progression de la maladie aux stades précoces. Il a récemment été démontré que l’acidose chronique était un facteur de risque dans la progression de la dysfonction rénale de l’IRC. Par conséquent, le traitement est obligatoire. Pratiquement, cela devrait consister en 1 à 2 cuillères à café de bicarbonate de sodium 2 à 3 fois par jour, ce qui est une thérapie peu coûteuse et sûre qui n’augmente pas la pression artérielle malgré l’augmentation du taux de sodium. Les taux cibles d’hémoglobine, selon les directives internationales, sont compris entre 10 g/ dL et 12 g/ dL. Le taux de phosphate sérique est élevé au stade 4 de l’IRC, et en particulier au stade 5 de l’IRC, qui est associé à une carotide coronarienne et à d’autres calcifications vasculaires et peut entraîner une cardiopathie ischémique, un infarctus du myocarde et un accident vasculaire cérébral. Une augmentation du taux d’hormone parathyroïdienne (hyperparathyroïdie secondaire) est également un facteur de risque majeur de maladie cardiovasculaire et est associée à une hypertension accrue et à une résistance au traitement de l’anémie associée à l’IRC.
La dyslipidémie
L’insuffisance rénale chronique (IRC) est associée à des altérations de la structure et de la fonction des lipoprotéines, notamment:
- réduction du cholestérol des lipoprotéines de haute densité
- augmentation des lipoprotéines de densité intermédiaire
- augmentation des particules lipidiques proathérogènes.
Importance du contrôle de la dyslipidémie
- Un traitement réussi de la dyslipidémie est connu pour réduire le risque de maladie cardiovasculaire (MCV) et devrait également retarder le déclin de la fonction rénale.
- Comme il a été démontré que les statines diminuent l’excrétion urinaire de protéines ou d’albumine, elles sont recommandées pour l’IRC avec protéinurie.
- Des remarques sur l’utilisation des statines dans les stades 3 à 5 de l’IRC sont données dans le tableau 1.
- L’utilisation simultanée de statines et de fibrates augmente le risque de rhabdomyolyse.
Cible pour le cholestérol à lipoprotéines de basse densité
- Les lignes directrices de l’Initiative pour la qualité des résultats de la maladie rénale (KDOQI) recommandent ce qui suit pour le traitement de la dyslipidémie dans les cas d’IRC: en cas de cholestérol à lipoprotéines de basse densité (LDL-C) < 3.5 mmol / L, la première étape est la modification du mode de vie; en cas de LDL-C > 3,5 mmol / L, un traitement médicamenteux doit être envisagé en plus de la modification du mode de vie, y compris la thérapie diététique, le contrôle du poids et l’exercice.
- Il est essentiel que le LDL-C soit abaissé à < 1,8 mmol /L.
Lignes directrices de KDOQI pour l’abaissement du cholestérol chez les patients atteints d’IRC (2013):
- Les patients > 50 ans doivent recevoir une statine.
- Les patients âgés de 18 à 49 ans doivent recevoir une statine si une autre comorbidité est présente.
- Les transplantés rénaux devraient recevoir une statine.
Traitement de l’hyperkaliémie et de l’acidose métabolique
Hyperkaliémie
- Au fur et à mesure que l’IRC progresse au stade, une acidose et une hyperkaliémie sont observées. L’hyperkaliémie est définie comme un taux de potassium sérique > 5,5 mmol / L. L’hyperkaliémie > 7 mmol / L peut potentiellement provoquer un arrêt cardiaque; ces cas doivent être traités comme des urgences.
- Si une hyperkaliémie sévère est observée, malgré l’absence de fonction rénale réduite, une pseudohyperkaliémie, un artefact dû à l’hémolyse de l’échantillon sanguin, doit être envisagée.
- L’hyperkaliémie est un facteur de risque d’arythmie. En cas d’hyperkaliémie sévère, les niveaux d’urgence doivent être confirmés par des anomalies de l’ECG telles que l’allongement des ondes T, l’allongement des temps PQ, suivi de la disparition de l’onde P et de l’élargissement du complexe QRS. Les patients présentant des résultats d’ECG potentiellement mortels, une bradycardie et une hypotension doivent être traités rapidement, suivis d’un traitement en collaboration avec un néphrologue.
- L’hyperkaliémie induite par le médicament dans l’IRC est principalement causée par des inhibiteurs de la rénine-angiotensine-aldostérone tels que les inhibiteurs de l’ECA, les inhibiteurs des récepteurs de l’angiotensine II (ARA) et la spironolactone ou une consommation excessive d’aliments contenant du potassium. D’autres causes comprennent l’administration de β-bloquants, de digoxine, d’anti-inflammatoires non stéroïdiens (AINS), de triméthoprime ou de pentamidine.
- L’IRC causée par une néphropathie diabétique peut être associée à un hypoaldostéronisme hyporéninémique, qui peut provoquer une hyperkaliémie malgré une fonction rénale relativement bien préservée. C’est ce qu’on appelle l’acidose tubulaire rénale de type IV.
Traitement d’urgence
- La première étape consiste à stabiliser le myocarde. L’administration intraveineuse de gluconate de calcium ne modifie pas le potassium plasmatique, mais améliore transitoirement l’ECG. L’administration de gluconate de calcium 20 mL par voie intraveineuse pendant 1 minute peut être répétée s’il n’y a pas d’amélioration de l’ECG dans les 3 à 5 minutes.
- La deuxième étape consiste à déplacer le potassium du compartiment extracellulaire vers le compartiment intracellulaire pour essayer de diminuer rapidement le taux de potassium sérique. Cela peut être fait de trois manières différentes:
- Insuline intraveineuse associée au glucose. Administrer 10 U d’insuline à action brève en association avec 50 mL de dextrose à 50 % en bolus, suivie d’une perfusion intraveineuse de dextrose à 5 % pour prévenir l’hypoglycémie.
- β2-agoniste. Administrer 20 mg de salbutamol, un agoniste β2, par inhalation pendant 10 minutes, avec un début d’action d’environ 30 minutes. (Ce n’est généralement pas nécessaire.)
- Bicarbonate de sodium chez les patients atteints d’IRC qui ne sont pas encore dialysés. L’administration de bicarbonate peut abaisser le potassium sérique en améliorant l’excrétion rénale du potassium. L’effet est très lent et n’est pas utile dans une situation aiguë à moins que le patient ne présente une acidose métabolique sévère nécessitant un traitement au bicarbonate.
- Une fois les mesures temporaires précédentes effectuées, d’autres interventions sont entreprises pour éliminer le potassium du corps.
- Les diurétiques de l’anse ne sont efficaces que chez les patients ayant une fonction rénale adéquate.
- L’échangeur de résine polystyrène sulfonate de sodium (Kexélate) élimine le potassium du sang dans l’intestin en échange d’une quantité égale de sodium. Il agit lentement et le potassium plasmatique ne commence à diminuer qu’en 1 à 2 heures. Il peut être administré par voie orale ou sous forme de lavement de rétention. La quantité donnée varie de 30 g à 60 g. Cela peut être répété, mais a tendance à provoquer de la constipation.
- L’hémodialyse est le traitement de choix pour les patients présentant une IRC avancée et une hyperkaliémie sévère.
Prévention
- Conseils diététiques sur la restriction potassique.
- Évitez les médicaments qui interfèrent avec l’excrétion rénale du potassium, par exemple les diurétiques épargneurs de potassium, les AINS, les inhibiteurs de l’ECA, les ARA.
- Évitez les médicaments qui interfèrent avec les déplacements du potassium des compartiments intracellulaires vers les compartiments extracellulaires, par exemple les β-bloquants non sélectifs.
- Chez certains patients ayant une fonction rénale résiduelle suffisante, un traitement par un diurétique de l’anse peut être utilisé pour stimuler l’excrétion urinaire de potassium.
Acidose métabolique
L’acidose métabolique est caractérisée par:
- pH sanguin artériel bas (acidémie) (<7.35)
- diminution de la concentration sérique en HCO3
- diminution de la pCO2 (de la compensation respiratoire).
Effets systémiques
L’acidose métabolique peut entraîner divers changements dans les tissus et les organes, p. ex.:
- modifications cardiovasculaires telles que tachycardie, bradycardie, hypotension et insuffisance cardiaque
- hyperkaliémie potentiellement mortelle
- nausées, vomissements et douleurs abdominales
- confusion, avec dépression du système nerveux central.
Les symptômes et signes associés dépendront du taux et de l’ampleur de la chute du pH et de la pathologie sous-jacente.
Acidose urémique
L’acidose métabolique survient en cas d’insuffisance rénale en raison d’une diminution de la capacité à excréter H+ ou d’une incapacité à produire de l’ammoniac.
Aux premiers stades de l’IRC (DFG < 40 mL / min), une acidose métabolique avec un écart anionique normal (AG) peut devenir évidente. À mesure que l’IRC progresse (DFG < 20 mL / min), une acidose métabolique AG élevée peut en résulter.
Dans l’IRC avancée, une augmentation de l’AG est typique en raison de la présence d’acides retenus tels que les sulfates, les phosphates, l’urate et l’hippurate.
Principes de traitement
Les patients atteints d’acidose métabolique sont souvent très malades et leur état a tendance à se détériorer rapidement.
L’administration de routine de bicarbonate de sodium est controversée, bien qu’elle doive être faite pour corriger une acidose sévère.
Les complications potentielles de l’administration de bicarbonate de sodium comprennent une surcharge volumique, en particulier chez les patients présentant une insuffisance rénale ou cardiaque, une hypernatrémie, une hypokaliémie, une hypocalcémie et une alcalose.
La quantité de bicarbonate nécessaire (mmol) peut être estimée comme suit:
HCO3 plasmatique cible (mmol / L) – HCO3 plasmatique actuel (mmol / L) x 40% de poids corporel (kg).
Anémie en cas d’IRC
L’anémie est la complication la plus fréquente de l’IRC et est associée à une qualité de vie considérablement réduite. Un traitement réussi de l’anémie dans l’insuffisance rénale peut réduire le déclin de la fonction rénale. Le taux d’ hémoglobine cible est de 10 à 12 g / dL lors du traitement de l’ anémie par IRC. Le traitement est coûteux et donc une prise en compte rationnelle est obligatoire.
Anémie rénale
L’anémie rénale est typiquement normocytaire normochromique. Elle est causée principalement par une altération de la production d’érythropoïétine par le rein et en partie par des toxines urémiques. Les autres causes pouvant jouer un rôle dans l’IRC, en particulier chez les patients dialysés, sont:
- résistance à l’érythropoïétine (la plus significative)
- toxines de la moelle osseuse (aucune n’a encore été isolée)
- fibrose médullaire secondaire à une hyperparathyroïdie
- processus inflammatoires en cours, p.ex. infections non traitées
- carence hématinique (fer, folate et vitamine B12)
- destruction accrue des globules rouges
- membranes érythrocytaires anormales, provoquant une fragilité osmotique accrue
- augmentation de la perte de sang due à des saignements gastro-intestinaux occultes et à des prélèvements sanguins et pendant l’hémodialyse
- inhibition de l’ECA.
L’érythropoïétine est une hormone glycoprotéique qui stimule la production de globules rouges en se liant aux récepteurs de l’érythropoïétine, situés sur les cellules progénitrices érythroïdes précoces de la moelle osseuse.
La liaison de l’érythropoïétine à ces cellules progénitrices les sauve de l’apoptose et permet donc la division cellulaire et la maturation en globules rouges. Dans l’IRC, les taux d’érythropoïétine peuvent être normaux, mais insuffisants pour le degré d’anémie. Les mécanismes altérant la production d’érythropoïétine dans les reins malades restent mal compris. L’inhibition de l’érythropoïèse par des inhibiteurs urémiques est également possible et peut contribuer grandement à l’anémie de l’IRC; de tels facteurs n’ont pas été identifiés. La dialyse peut améliorer l’anémie rénale et l’efficacité des agents stimulant l’érythropoïétine. Les patients atteints d’insuffisance rénale peuvent développer des infections chroniques et d’autres maladies chroniques. La maladie chronique contribue à l’anémie dans de tels cas. L’anémie de la maladie chronique est médiée par des cytokines inflammatoires par l’inhibition de la production et de l’efficacité de l’érythropoïétine et une diminution de la disponibilité en fer.
L’hepcidine est le médiateur clé du métabolisme du fer. Dans les états inflammatoires, l’hepcidine bloque l’absorption du fer dans l’intestin et favorise la séquestration du fer dans les macrophages.
Autres causes
L’anémie associée à une IRC est très probablement une anémie rénale; cependant, le différentiel pour d’autres maladies doit être considéré comme vrai pour les stades 1 à 3 de l’IRC.
L’évaluation de l’anémie chez les patients atteints d’IRC doit inclure une numération globulaire complète avec des indices de globules rouges (taux d’hémoglobine corpusculaire moyen, volume corpusculaire moyen). L’anémie rénale est généralement normochrome et normocytaire. Une carence en vitamine B12 et en folates peut entraîner une macrocytose, tandis qu’une carence en fer ou des troubles héréditaires de l’hémoglobine peuvent entraîner une microcytose. Des études sur le fer doivent être effectuées pour évaluer le taux de fer dans les réserves de tissus ou l’adéquation de l’apport en fer pour l’érythropoïèse.
L’anémie peut signifier la présence d’une malnutrition ou d’une maladie systémique. C’est un facteur de risque indépendant d’hospitalisation, de MCV et de mortalité. Les inhibiteurs de l’ECA peuvent exacerber l’anémie.
Le traitement de l’anémie protège le cœur
L’anémie aggrave l’insuffisance cardiaque. Le traitement de l’anémie est bénéfique pour l’espérance de vie et peut également améliorer le pronostic des MCV. La qualité de vie est améliorée pour ceux dont le taux d’hémoglobine se situe dans la fourchette cible.
Taux cible d’hémoglobine
Les lignes directrices sur l’amélioration des résultats globaux de l’insuffisance rénale (KDIGO) indiquent que le taux d’hémoglobine doit varier de 10,0 g/dL à 12 g/dL chez les patients dialysés atteints d’IRC. Les niveaux de pré-dialyse doivent être de 10 g / dL.
Partage des rôles entre les néphrologues et les médecins de soins primaires
Il est conseillé de consulter rapidement un néphrologue. Une fois la stratégie de traitement décidée, les néphrologues et les médecins de soins primaires poursuivent la prise en charge en partenariat.
Évaluation de la carence en fer
L’évaluation du déficit en fer et de l’apport correct en fer est importante dans le traitement de l’anémie. L’anémie peut s’améliorer avec l’administration de suppléments de fer, même si le patient n’est apparemment pas déficient en fer, car l’utilisation d’érythropoïétine recombinante peut entraîner une carence relative en fer.
Les lignes directrices de KDOQI pour l’érythropoïétine humaine recombinante dans l’IRC sont les suivantes:
- ferritine sérique > 100 ng / mL avant dialyse
- ferritine sérique > 200 ng / mL chez les patients dialysés
- saturation en transferrine > 20%.
Le fer peut être administré par voie intraveineuse ou orale. Le fer intraveineux est plus efficace, en particulier pour les patients dialysés et ceux sous traitement à l’érythropoïétine.
Utilisation d’érythropoïétines exogènes
Il existe actuellement un certain nombre d’agents stimulant l’érythropoïétine, y compris des médicaments plus anciens à action plus courte et de nouveaux médicaments à action plus longue. L’agent et la dose appropriés dépendent d’un certain nombre de facteurs, notamment le coût, l’efficacité et la commodité. Comme ces médicaments sont chers et ont des effets secondaires, il est préférable de laisser leur prise en charge à un néphrologue.
Troubles osseux et minéraux
L’hyperphosphatémie est l’anomalie clé qui déclenche une cascade d’événements métaboliques, entraînant une densité minérale osseuse de l’IRC.
Le phosphate est retenu lorsque la fonction rénale se détériore – de la même manière que la créatinine est retenue. Cette rétention devient évidente au fur et à mesure que l’étape 3b CKD est atteinte. Elle s’aggravera progressivement à mesure que le stade final approchera et doit être abaissée à l’intérieur des limites normales.
Un régime riche en phosphate stimule les ostéocytes à produire un facteur de croissance des fibroblastes 23 qui, à son tour, inhibe l’hydroxylation de la vitamine D en vitamine D1,25 active D3. Sans vitamine D3, l’absorption du calcium et le remodelage osseux sont diminués. L’hypocalcémie qui en résulte est un stimulant majeur de la libération de l’hormone parathyroïdienne (PTH), avec pour conséquence le développement d’une maladie osseuse rénale. La phosphatase alcaline sérique est un marqueur d’augmentation du renouvellement osseux. Par conséquent, des taux sanguins élevés montrent une activité PTH.
Il convient de noter que l’hyperphosphatémie et la carence en vitamine D3 entraînent une augmentation de la sécrétion de PTH.
Initialement, le stimulus de la sécrétion de PTH peut être contrôlé en augmentant le calcium sérique, en réduisant les taux de phosphate dans le sang et en prescrivant de la vitamine D3. C’est le stade secondaire de l’hyperparathyroïdie (tableau 2). Cependant, avec le temps et une stimulation incontrôlée et prolongée de la sécrétion de PTH, les hormones parathyroïdes deviennent autonomes et le stade d’hyperparathyroïdie autonome est atteint (tableau 3). La parathyroïdectomie peut maintenant être nécessaire ou des médicaments calcimimétiques coûteux doivent être administrés pour tenter de restaurer l’environnement métabolique désordonné.


Il existe une incertitude quant à l’interprétation des mesures du taux de vitamine D3. S’ils doivent être mesurés, il est recommandé d’évaluer les niveaux de 25-OH-vitamine D3.
Thérapie
Les étapes du traitement sont indiquées dans le tableau 4. Des liants phosphatés non calciques sont recommandés en cas de calcification métastatique significative et / ou en cas d’hypercalcémie.
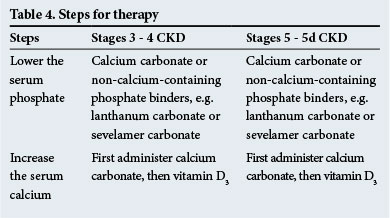
Les calcimimétiques, qui sensibilisent les glandes parathyroïdes au calcium sérique, sont utiles à prescrire dans l’hyperparathyroïdie lorsque les taux sériques de PTH sont élevés (2 à 9 fois au-dessus de la plage normale – vérifiez auprès du laboratoire pour des plages normales). Ils ont un rôle à jouer dans la diminution des taux de PTH dans toutes les situations cliniques qui surviennent dans l’IRC.
Mesures sanguines de suivi
Celles-ci sont données dans le tableau 5.
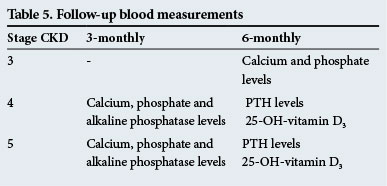
Ces délais de suivi ne sont que des directives et les tests doivent être effectués plus fréquemment en cas d’anomalies significatives.
Points spéciaux à noter
- Impliquent un néphrologue au début de l’IRC.
- Évitez la sur-suppression des glandes parathyroïdes, car cela entraînera une maladie osseuse dynamique.
- Le niveau exact de PTH auquel l’hyperparathyroïdie secondaire et autonome est diagnostiquée est incertain, en raison de tests variables. La biochimie, telle que décrite ci-dessus (ainsi que les radiographies des os), doit ensuite être utilisée pour aider au diagnostic.
- Soyez au courant des tendances des taux sériques de phosphatases alcalines; le taux peut se situer dans la plage normale, mais peut avoir doublé par rapport à la lecture précédente.
- L’ostéoporose accompagne la maladie osseuse qui survient dans l’IRC. Les bisphosphonates ne doivent pas être utilisés chez les patients aux stades 3 à 5 de l’IRC.