MEDIZINISCHE WEITERBILDUNG
ARTIKEL
Wichtige Komplikationen der chronischen Nierenerkrankung
I van der WaltI; CR SwanepoelII; B MahalaIII; A M MeyersIV
Korrespondenz
ZUSAMMENFASSUNG
Die Komplikationen der chronischen Nierenerkrankung (CKD) sind Dyslipidämie, Hyperkaliämie, metabolische Azidose, Anämie sowie Knochen- und Mineralstoffstörungen. Dyslipidämie kann mit Lipoproteinsenkern niedriger Dichte behandelt werden. Statine sind in den Stadien 4 und 5 CKD unwirksam, sind jedoch indiziert, um das Fortschreiten der Krankheit in den früheren Stadien zu verhindern. Chronische Azidose hat sich kürzlich als Risikofaktor für das Fortschreiten der CKD-Nierenfunktionsstörung erwiesen. Daher ist die Behandlung obligatorisch. Praktisch sollte dies aus 1 – 2 gehäuften Teelöffeln Natriumbicarbonat 2 – 3 mal pro Tag bestehen, was eine kostengünstige und sichere Therapie ist, die den Blutdruck trotz des erhöhten Natriumspiegels nicht erhöht. Die Zielwerte für Hämoglobin liegen nach internationalen Richtlinien zwischen 10 g/dl und 12 g/dl. Der Serumphosphatspiegel ist bei CKD im Stadium 4 und insbesondere bei CKD im Stadium 5 erhöht, was mit koronarer Karotis und anderen Gefäßverkalkungen einhergeht und zu ischämischer Herzkrankheit, Myokardinfarkt und Schlaganfall führen kann. Ein erhöhter Nebenschilddrüsenhormonspiegel (sekundärer Hyperparathyreoidismus) ist ebenfalls ein Hauptrisikofaktor für Herz-Kreislauf-Erkrankungen und ist mit einer erhöhten Hypertonie und Resistenz gegen die Behandlung der CKD-assoziierten Anämie verbunden.
Dyslipidämie
Chronische Nierenerkrankung (CKD) ist mit Veränderungen der Lipoproteinstruktur und -funktion verbunden, einschließlich:
- reduziertes High-Density-Lipoprotein-Cholesterin
- erhöhtes Intermediate-Density-Lipoprotein
- erhöhte proatherogene Lipidpartikel.
Bedeutung der Dyslipidämie-Kontrolle
- Es ist bekannt, dass eine erfolgreiche Behandlung der Dyslipidämie das Risiko für kardiovaskuläre Erkrankungen (CVD) senkt und auch den Rückgang der Nierenfunktion verzögern sollte.
- Da Statine nachweislich die Protein- oder Albuminausscheidung im Urin verringern, werden sie für CKD mit Proteinurie empfohlen.
- Anmerkungen zur Statinanwendung in den Stadien 3 – 5 CKD sind in Tabelle 1 aufgeführt.
- Die gleichzeitige Anwendung von Statinen und Fibraten erhöht das Risiko einer Rhabdomyolyse.
Ziel für Low-Density-Lipoprotein-Cholesterin
- Die Richtlinien der Kidney Disease Outcomes Quality Initiative (KDOQI) empfehlen Folgendes für die Dyslipidämie-Therapie bei CKD: in Fällen von Low-Density-Lipoprotein-Cholesterin (LDL-C) <3.5 mmol / l, der erste Schritt ist die Änderung des Lebensstils; Bei LDL-C >3, 5 mmol / L sollte zusätzlich zur Änderung des Lebensstils eine medikamentöse Therapie in Betracht gezogen werden, einschließlich Diättherapie, Gewichtskontrolle und Bewegung.
- Es ist wichtig, dass LDL-C auf < 1,8 mmol / L gesenkt wird.
KDOQI-Richtlinien zur Cholesterinsenkung bei CKD-Patienten (2013):
- Patienten > 50 Jahre sollten ein Statin erhalten.
- Patienten im Alter von 18 – 49 Jahren sollten ein Statin erhalten, wenn eine andere Komorbidität vorliegt.
- Nierentransplantatempfänger sollten ein Statin erhalten.
Behandlung von Hyperkaliämie und metabolischer Azidose
Hyperkaliämie
- Mit fortschreitender CKD werden Azidose und Hyperkaliämie beobachtet. Hyperkaliämie ist definiert als ein Serumkaliumspiegel >5,5 mmol/L. Hyperkaliämie >7 mmol/l kann möglicherweise einen Herzstillstand verursachen; solche Fälle sollten als Notfälle behandelt werden.
- Wenn trotz fehlender eingeschränkter Nierenfunktion eine schwere Hyperkaliämie beobachtet wird, sollte eine Pseudohyperkaliämie, ein Artefakt aufgrund einer Hämolyse der Blutprobe, in Betracht gezogen werden.
- Hyperkaliämie ist ein Risikofaktor für Arrhythmien. Bei schwerer Hyperkaliämie sollten die Notfallwerte durch EKG-Anomalien wie Tent-T-Wellen, Verlängerung der PQ-Zeiten, gefolgt vom Verschwinden der P-Welle und Erweiterung des QRS-Komplexes bestätigt werden. Patienten mit lebensbedrohlichen EKG-Befunden, Bradykardie und Hypotonie sollten umgehend behandelt werden, gefolgt von einer Behandlung in Verbindung mit einem Nephrologen.
- Arzneimittelinduzierte Hyperkaliämie bei CKD wird hauptsächlich durch Renin-Angiotensin-Aldosteron-Hemmer wie ACE-Hemmer, Angiotensin-II-Rezeptorblocker (ARBs) und Spironolacton oder übermäßige Aufnahme kaliumhaltiger Lebensmittel verursacht. Andere Ursachen sind die Verabreichung von β-Blockern, Digoxin, nichtsteroidalen Antirheumatika (NSAIDs), Trimethoprim oder Pentamidin.
- Eine durch diabetische Nephropathie verursachte CKD kann mit einem hyporeninämischen Hypoaldosteronismus assoziiert sein, der trotz relativ gut erhaltener Nierenfunktion eine Hyperkaliämie verursachen kann. Dies wird als renale tubuläre Azidose Typ IV bezeichnet.
Notfallbehandlung
- Der erste Schritt ist die Stabilisierung des Herzmuskels. Die intravenöse Verabreichung von Calciumgluconat verändert das Plasmakalium nicht, verbessert jedoch vorübergehend das EKG. Die Verabreichung von Calciumgluconat 20 ml intravenös über 1 Minute kann wiederholt werden, wenn sich das EKG innerhalb von 3 – 5 Minuten nicht verbessert.
- Der zweite Schritt besteht darin, das Kalium vom extrazellulären in das intrazelluläre Kompartiment zu verschieben, um zu versuchen, den Serumkaliumspiegel schnell zu senken. Dies kann auf drei verschiedene Arten erfolgen:
- Intravenöses Insulin in Kombination mit Glukose. Verabreichen Sie 10 E kurzwirksames Insulin in Kombination mit 50 ml 50% iger Dextrose als Bolus, gefolgt von einer intravenösen Infusion von 5% iger Dextrose, um eine Hypoglykämie zu verhindern.
- β2-Agonist. Verabreichen Sie 20 mg Salbutamol, einen β2-Agonisten, durch Inhalation über 10 Minuten, wobei die Wirkung etwa 30 Minuten einsetzt. (Dies ist normalerweise nicht erforderlich.)
- Natriumbicarbonat bei CKD-Patienten, die noch nicht dialysiert sind. Die Verabreichung von Bicarbonat kann das Serumkalium senken, indem es die renale Kaliumausscheidung erhöht. Die Wirkung ist sehr langsam und in einer akuten Situation nicht von Nutzen, es sei denn, der Patient hat eine schwere metabolische Azidose, die eine Bicarbonatbehandlung erfordert.
- Sobald die vorherigen vorübergehenden Maßnahmen durchgeführt wurden, werden weitere Eingriffe durchgeführt, um Kalium aus dem Körper zu entfernen.
- Schleifendiuretika sind nur bei Patienten mit ausreichender Nierenfunktion erfolgreich.
- Der Harzaustauscher Natriumpolystyrolsulfonat (Kexelat) entfernt Kalium aus dem Blut in den Darm im Austausch für eine gleiche Menge Natrium. Es wirkt langsam und das Plasmakalium beginnt erst innerhalb von 1 – 2 Stunden abzunehmen. Es kann oral oder als Retentionseinlauf verabreicht werden. Die angegebene Menge variiert zwischen 30 g und 60 g. Dies kann wiederholt werden, neigt jedoch dazu, Verstopfung zu verursachen.
- Hämodialyse ist die Behandlung der Wahl für Patienten mit fortgeschrittener CKD und schwerer Hyperkaliämie.
Prävention
- Ernährungsberatung zur Kaliumrestriktion.
- Vermeiden Sie Medikamente, die die renale Ausscheidung von Kalium beeinträchtigen, z. B. kaliumsparende Diuretika, NSAIDs, ACE-Hemmer, ARBs.
- Vermeiden Sie Arzneimittel, die die Kaliumverschiebung von den intrazellulären zu den extrazellulären Kompartimenten stören, z. B. nichtselektive β-Blocker.
- Bei ausgewählten Patienten mit ausreichender Restnierenfunktion kann die Behandlung mit einem Schleifendiuretikum angewendet werden, um die Kaliumausscheidung im Urin zu stimulieren.
Metabolische Azidose
Metabolische Azidose ist gekennzeichnet durch:
- niedriger arterieller Blut-pH-Wert (Aziämie) (<7.35)
- reduzierte Serum-HCO3- Konzentration
- vermindertes pCO2 (durch Atemkompensation).
Systemische Wirkungen
Metabolische Azidose kann zu einer Vielzahl von Veränderungen in Geweben und Organen führen, z.:
- kardiovaskuläre Veränderungen wie Tachykardie, Bradykardie, Hypotonie und Herzinsuffizienz
- lebensbedrohliche Hyperkaliämie
- Übelkeit, Erbrechen und Bauchschmerzen
- Verwirrtheit mit Depression des Zentralnervensystems.
Die damit verbundenen Symptome und Anzeichen hängen von der Geschwindigkeit und dem Ausmaß des pH-Abfalls und der zugrunde liegenden Pathologie ab.
Urämische Azidose
Metabolische Azidose tritt bei Nierenversagen aufgrund einer verminderten Fähigkeit zur Ausscheidung von H + oder einer Unfähigkeit zur Ammoniakproduktion auf.
In den frühen Stadien der CKD (GFR < 40 ml / min) kann eine metabolische Azidose mit einer normalen Anionenlücke (AG) auftreten. Mit fortschreitender CKD (GFR < 20 ml / min) kann eine metabolische Azidose mit hohem AG-Wert auftreten.
Bei fortgeschrittener CKD ist eine erhöhte AG aufgrund der Anwesenheit von Fettsäuren wie Sulfaten, Phosphaten, Urat und Hippurat typisch.
Behandlungsprinzipien
Patienten mit metabolischer Azidose sind oft sehr krank und ihr Zustand neigt dazu, sich schnell zu verschlechtern.
Die routinemäßige Verabreichung von Natriumbicarbonat ist umstritten, obwohl dies zur Korrektur einer schweren Azidose erforderlich ist.
Zu den möglichen Komplikationen bei der Verabreichung von Natriumbicarbonat gehört eine Volumenüberlastung, insbesondere bei Patienten mit eingeschränkter Nieren- oder Herzfunktion, Hypernatriämie, Hypokaliämie, Hypokalzämie und Alkalose.
Die benötigte Bicarbonatmenge (mmol) kann wie folgt geschätzt werden:
Zielplasma HCO3- (mmol/L) – aktuelles Plasma HCO3- (mmol/L) x 40% Körpergewicht (kg).
Anämie bei CKD
Anämie ist die häufigste Komplikation der CKD und ist mit einer stark verminderten Lebensqualität verbunden. Eine erfolgreiche Behandlung der Anämie bei Nierenerkrankungen kann den Rückgang der Nierenfunktion verringern. Die Zielhämoglobinwerte liegen bei der Behandlung von Anämie bei CKD bei 10 – 12 g/dl. Die Behandlung ist kostspielig und daher ist eine rationale Betrachtung erforderlich.
Renale Anämie
Renale Anämie ist typischerweise normochromnormozytisch. Es wird hauptsächlich durch die gestörte Produktion von Erythropoetin durch die Niere und teilweise durch urämische Toxine verursacht. Andere Ursachen, die bei CKD eine Rolle spielen können, insbesondere bei Dialysepatienten, sind:
- erythropoietinresistenz (am signifikantesten)
- Knochenmarkstoxine (noch keine isoliert)
- Knochenmarkfibrose, sekundär zu Hyperparathyreoidismus
- laufende entzündliche Prozesse, z. unbehandelte Infektionen
- Hämatinmangel (Eisen, Folsäure und Vitamin B12)
- erhöhte Zerstörung roter Blutkörperchen
- abnormale Membranen roter Blutkörperchen, die eine erhöhte osmotische Fragilität verursachen
- erhöhter Blutverlust durch okkulte gastrointestinale Blutungen und Blutentnahme und während der Hämodialyse
- ACE-Hemmung.
Erythropoetin ist ein Glykoproteinhormon, das die Produktion roter Blutkörperchen stimuliert, indem es an Erythropoetinrezeptoren bindet, die sich auf frühen erythroiden Vorläuferzellen im Knochenmark befinden.
Die Bindung von Erythropoetin an diese Vorläuferzellen bewahrt sie vor Apoptose und ermöglicht daher die Zellteilung und Reifung zu roten Blutkörperchen. Bei CKD können die Erythropoetinspiegel normal, aber für den Grad der Anämie unzureichend sein. Die Mechanismen, die die Erythropoetinproduktion bei erkrankten Nieren beeinträchtigen, sind nach wie vor wenig bekannt. Eine Hemmung der Erythropoese durch urämische Inhibitoren ist ebenfalls möglich und kann erheblich zur Anämie der CKD beitragen; solche Faktoren wurden nicht identifiziert. Die Dialyse kann die renale Anämie und die Wirksamkeit von Erythropoetin-stimulierenden Wirkstoffen verbessern. Patienten mit Nierenerkrankungen können chronische Infektionen und andere chronische Krankheiten entwickeln. Chronische Erkrankungen tragen in solchen Fällen zur Anämie bei. Die Anämie chronischer Erkrankungen wird durch inflammatorische Zytokine durch Hemmung der Erythropoetinproduktion und -wirksamkeit und verminderte Eisenverfügbarkeit vermittelt.
Hepcidin ist der Schlüsselmediator des Eisenstoffwechsels. In entzündlichen Zuständen blockiert Hepcidin die Eisenaufnahme im Darm und fördert die Eisensequestrierung in Makrophagen.
Andere Ursachen
Anämie im Zusammenhang mit CKD ist höchstwahrscheinlich renale Anämie; das Differential für andere Krankheiten muss jedoch für die Stadien 1 – 3 CKD als wahr angesehen werden.
Die Beurteilung der Anämie bei CKD-Patienten sollte ein vollständiges Blutbild mit Erythrozytenindizes (mittlere korpuskuläre Hämoglobinkonzentration, mittleres korpuskuläres Volumen) umfassen. Die renale Anämie ist in der Regel normochromär und normozytär. Ein Mangel an Vitamin B12 und Folsäure kann zu Makrozytose führen, während Eisenmangel oder vererbte Störungen des Hämoglobins zu Mikrozytose führen können. Eisenuntersuchungen sollten durchgeführt werden, um den Eisengehalt in den Gewebespeichern oder die Angemessenheit der Eisenversorgung für die Erythropoese zu beurteilen.
Anämie kann auf Mangelernährung oder systemische Erkrankungen hinweisen. Es ist ein unabhängiger Risikofaktor für Krankenhausaufenthalt, CVD und Mortalität. ACE-Hemmer können Anämie verschlimmern.
Behandlung der Anämie schützt das Herz
Anämie verschlimmert die Herzinsuffizienz. Die Behandlung von Anämie ist vorteilhaft für die Lebenserwartung und kann auch die Prognose von CVD verbessern. Die Lebensqualität wird bei Patienten verbessert, deren Hämoglobinspiegel innerhalb des Zielbereichs liegt.
Zielhämoglobinspiegel
Die Richtlinien zur Verbesserung des globalen Ergebnisses bei Nierenerkrankungen (KDIGO) besagen, dass der Hämoglobinspiegel bei dialysierten CKD-Patienten zwischen 10,0 g / dl und 12 g/ dl liegen sollte. Die Prädialysespiegel sollten bei 10 g / dl liegen.
Rollenteilung zwischen Nephrologen und Hausärzten
Eine frühzeitige Überweisung an einen Nephrologen ist ratsam. Sobald die Behandlungsstrategie festgelegt ist, setzen Nephrologen und Hausärzte das Management in Partnerschaft fort.
Bewertung des Eisenmangels
Die Bewertung des Eisenmangels und die korrekte Eisenversorgung sind wichtig bei der Behandlung von Anämie. Die Anämie kann sich mit der Gabe von Eisenpräparaten bessern, auch wenn der Patient keinen offensichtlichen Eisenmangel aufweist, da die Anwendung von rekombinantem Erythropoetin einen relativen Eisenmangel verursachen kann.
Die KDOQI-Richtlinien für rekombinantes humanes Erythropoetin bei CKD sind:
- Serumferritin >100 ng/ml vor der Dialyse
- Serumferritin >200 ng/ml bei Dialysepatienten
- Transferrinsättigung >20%.
Eisen kann entweder intravenös oder oral verabreicht werden. Intravenöses Eisen ist wirksamer, insbesondere für Dialysepatienten und solche unter Erythropoetin-Behandlung.
Verwendung von exogenen Erythropoietinen
Derzeit stehen eine Reihe von Erythropoietin-stimulierenden Wirkstoffen zur Verfügung, darunter ältere, kürzer wirkende Arzneimittel und neue, länger wirkende Arzneimittel. Das geeignete Mittel und die Dosis hängen von einer Reihe von Faktoren ab, einschließlich Kosten, Wirksamkeit und Bequemlichkeit. Da diese Medikamente teuer sind und Nebenwirkungen haben, wird ihr Management am besten einem Nephrologen überlassen.
Knochen- und Mineralstoffstörungen
Hyperphosphatämie ist die Schlüsselanomalie, die eine Kaskade von Stoffwechselereignissen auslöst, was zu einer Knochenmineraldichte von CKD führt.
Phosphat bleibt erhalten, wenn sich die Nierenfunktion verschlechtert – ähnlich wie Kreatinin. Diese Retention wird offensichtlich, wenn Stadium 3b CKD erreicht ist. Es wird sich zunehmend verschlechtern, wenn sich das Endstadium nähert, und muss innerhalb normaler Grenzen gesenkt werden.
Eine Ernährung mit hohem Phosphatgehalt stimuliert die Osteozyten zur Produktion des Fibroblastenwachstumsfaktors 23, der wiederum die Hydroxylierung von Vitamin D zu aktivem 1,25 Vitamin D3 hemmt. Ohne Vitamin D3 sind die Kalziumaufnahme und der Knochenumbau verringert. Die daraus resultierende Hypokalzämie ist ein wichtiger Stimulus für die Freisetzung von Parathyroidhormon (PTH) mit der daraus resultierenden Entwicklung von Nierenknochenerkrankungen. Die alkalische Phosphatase im Serum ist ein Marker für einen erhöhten Knochenumsatz. Daher zeigen hohe Blutspiegel PTH-Aktivität.
Bemerkenswert ist, dass sowohl Hyperphosphatämie als auch Vitamin-D3-Mangel zu einer erhöhten PTH-Sekretion führen.
Anfänglich kann der Stimulus für die PTH-Sekretion durch Erhöhung des Serumcalciums, Senkung des Phosphatspiegels im Blut und Verschreibung von Vitamin D3 kontrolliert werden. Dies ist das sekundäre Hyperparathyreoidismusstadium (Tabelle 2). Mit der Zeit und unkontrollierter, längerer Stimulation der PTH-Sekretion werden die Nebenschilddrüsenhormone jedoch autonom und das Stadium des autonomen Hyperparathyreoidismus ist erreicht (Tabelle 3). Parathyreoidektomie kann jetzt notwendig sein oder teure Calcimimetika müssen verabreicht werden, um zu versuchen, die gestörte metabolische Umgebung wiederherzustellen.


Es besteht Unsicherheit über die Interpretation von Vitamin-D3-Spiegelmessungen. Wenn sie gemessen werden sollen, werden 25-OH-Vitamin-D3-Spiegel zur Beurteilung empfohlen.
Therapie
Die Schritte zur Therapie sind in Tabelle 4 dargestellt. Nicht calciumhaltige Phosphatbinder werden empfohlen, wenn eine signifikante metastatische Verkalkung vorliegt und / oder wenn eine Hyperkalzämie vorliegt.
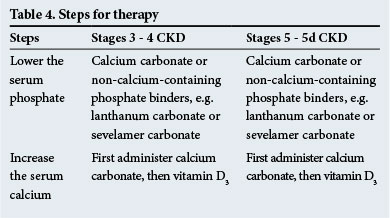
Calcimimetika, die die Nebenschilddrüsen für Serumcalcium sensibilisieren, sind bei Hyperparathyreoidismus nützlich, wenn die Serum-PTH-Spiegel hoch sind (2 – 9 mal über dem Normalbereich – erkundigen Sie sich beim Labor nach normalen Bereichen). Sie spielen eine Rolle bei der Verringerung der PTH-Spiegel in allen klinischen Situationen, die bei CKD auftreten.
Folgeblutmessungen
Diese sind in Tabelle 5 angegeben.
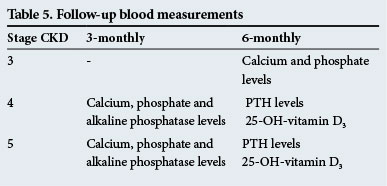
Diese Nachbeobachtungszeiten sind nur Richtlinien und die Tests sollten häufiger durchgeführt werden, wenn signifikante Anomalien vorliegen.
Besondere Punkte zu beachten
- Beziehen Sie einen Nephrologen früh im Verlauf der CKD.
- Vermeiden Sie eine übermäßige Unterdrückung der Nebenschilddrüsen, da dies zu einer dynamischen Knochenerkrankung führen kann.
- Das genaue PTH-Niveau, bei dem sekundärer und autonomer Hyperparathyreoidismus diagnostiziert wird, ist aufgrund unterschiedlicher Assays ungewiss. Die Biochemie, wie oben beschrieben (zusammen mit Röntgenaufnahmen von Knochen), muss dann zur Unterstützung der Diagnose verwendet werden.
- Achten Sie auf Trends bei den Serumspiegeln der alkalischen Phosphatase; Der Spiegel kann im normalen Bereich liegen, sich aber gegenüber dem vorherigen Messwert verdoppelt haben.
- Osteoporose begleitet Knochenerkrankungen, die bei CKD auftreten. Bisphosphonate dürfen bei CKD-Patienten im Stadium 3 – 5 nicht angewendet werden.