fortsat medicinsk uddannelse
artikel
vigtige komplikationer af kronisk nyresygdom
i van Der Valti; C R Svanepoelii; B MahalaIII; A M MeyersIV
korrespondance
abstrakt
komplikationerne ved kronisk nyresygdom (CKD) er dyslipidæmi hyperkaliæmi, metabolisk acidose, anæmi og knogler og mineraler. Dyslipidæmi kan behandles med lavdensitetslipoproteinsænkende midler. Statiner er ineffektive i trin 4 og 5 CKD, men er indiceret til forebyggelse af sygdomsprogression i de tidligere stadier. Kronisk acidose har for nylig vist sig at være en risikofaktor i udviklingen af CKD-nyresvigt. Derfor er behandling obligatorisk. Praktisk set bør dette bestå af 1 – 2 hævede teskefulde natriumbicarbonat 2-3 gange om dagen, hvilket er en billig og sikker terapi, der ikke hæver blodtrykket på trods af det øgede natriumniveau. Målniveauerne for hæmoglobin ligger i henhold til internationale retningslinjer mellem 10 g/dL og 12 g/dl. Serumphosphatniveauet hæves i fase 4 CKD, og især i fase 5 CKD, som er forbundet med koronar carotid og andre vaskulære forkalkninger og kan resultere i iskæmisk hjertesygdom, myokardieinfarkt og slagtilfælde. Et forhøjet parathyroidhormonniveau (sekundær hyperparathyroidisme) er også en væsentlig risikofaktor for hjerte-kar-sygdomme og er forbundet med øget hypertension og resistens over for behandling af CKD-associeret anæmi.
dyslipidæmi
kronisk nyresygdom (CKD) er forbundet med ændringer i lipoproteinstruktur og funktion, herunder:
- reduceret lipoproteinkolesterol med høj densitet
- øget lipoprotein med mellemdensitet
- øgede proatherogene lipidpartikler.
Betydning af dyslipidæmikontrol
- vellykket behandling af dyslipidæmi er kendt for at nedsætte risikoen for hjerte-kar-sygdomme (CVD) og bør også forsinke nedgangen i nyrefunktionen.
- da statiner har vist sig at nedsætte urinprotein eller albuminudskillelse, anbefales de til CKD med proteinuri.
- bemærkninger om statinanvendelse i trin 3 – 5 CKD er angivet i tabel 1.
- samtidig brug af statiner og fibrater øger risikoen for rabdomyolyse.
mål for lavdensitetslipoproteinkolesterol
- retningslinjerne for Kvalitetsinitiativ for nyresygdom anbefaler følgende for dyslipidæmibehandling ved CKD: i tilfælde af lavdensitetslipoproteinkolesterol (LDL-C) < 3.5 mmol/L, det første trin er livsstilsændring; i tilfælde af LDL-C >3,5 mmol / L bør lægemiddelbehandling overvejes ud over livsstilsændring, herunder diætterapi, vægtkontrol og motion.
- det er vigtigt, at LDL-C sænkes til <1, 8 mmol / l,
kdoki-retningslinjer for kolesterolsænkning hos CKD-patienter (2013):
- patienter > 50 år skal modtage et statin.
- patienter i alderen 18-49 år skal modtage et statin, hvis der er en anden comorbiditet.
- nyretransplantatmodtagere skal modtage et statin.
behandling af hyperkaliæmi og metabolisk acidose
hyperkaliæmi
- efterhånden som CKD skrider frem i stadiet, observeres acidose og hyperkaliæmi. Hyperkaliæmi er defineret som et serumkaliumniveau >5, 5 mmol/L. hyperkaliæmi >7 mmol/L kan potentielt forårsage hjertestop; sådanne tilfælde skal behandles som nødsituationer.
- hvis der observeres alvorlig hyperkaliæmi, på trods af manglende nedsat nyrefunktion, bør pseudohyperkaliæmi, en artefakt som følge af hæmolyse af blodprøven, overvejes.
- hyperkaliæmi er en risikofaktor for arytmier. I tilfælde af alvorlig hyperkaliæmi skal nødniveauerne bekræftes ved EKG-abnormiteter såsom teltbølger, forlængelse af PK-tider efterfulgt af forsvinden af P-bølgen og udvidelse af KRS-komplekset. Patienter med livstruende EKG-fund, bradykardi og hypotension skal behandles straks efterfulgt af behandling sammen med en nefrolog.
- lægemiddelinduceret hyperkaliæmi i CKD er hovedsageligt forårsaget af renin-angiotensin-aldosteroninhibitorer, såsom ACE-hæmmere, angiotensin II-receptorblokkere (ARB ‘ er) og spironolacton eller overdreven indtagelse af kaliumholdige fødevarer. Andre årsager omfatter administration af cholin-blokkere, digoksin, ikke-steroide antiinflammatoriske lægemidler (NSAID ‘ er), trimethoprim eller pentamidin.
- CKD forårsaget af diabetisk nefropati kan være forbundet med hyporeninæmisk hypoaldosteronisme, som kan forårsage hyperkaliæmi på trods af relativt velbevaret nyrefunktion. Dette er kendt som type IV renal tubulær acidose.
nødbehandling
- det første trin er at stabilisere myokardiet. Den intravenøse administration af calciumgluconat ændrer ikke plasmakalium, men forbedrer forbigående EKG. Indgivelse af calciumgluconat 20 mL intravenøst over 1 minut kan gentages, hvis der ikke er nogen forbedring i EKG inden for 3 – 5 minutter.
- det andet trin er at skifte kalium fra det ekstracellulære til det intracellulære rum for at forsøge hurtigt at reducere serumkaliumniveauet. Dette kan gøres på tre forskellige måder:
- intravenøst insulin kombineret med glucose. Indgiv 10 E korttidsvirkende insulin kombineret med 50 mL 50% glucoseinfusion som bolus efterfulgt af en intravenøs infusion af 5% glucoseinfusion for at forebygge hypoglykæmi.
- krir2-agonist. Indgiv 20 mg salbutamol, en larr2-agonist, ved inhalation over 10 minutter, med virkningsstart cirka 30 minutter. (Dette er normalt ikke nødvendigt .)
- natriumbicarbonat hos CKD-patienter, der endnu ikke er i dialyse. Administration af bicarbonat kan sænke serumkalium ved at øge udskillelsen af nyrekalium. Effekten er meget langsom og ikke til brug i en akut situation, medmindre patienten har svær metabolisk acidose, der har brug for bicarbonatbehandling.
- når de tidligere midlertidige foranstaltninger er udført, gennemføres yderligere indgreb for at fjerne kalium fra kroppen.
- loop diuretika er kun vellykket hos patienter med tilstrækkelig nyrefunktion.
- harpiksveksleren natriumpolystyrensulfonat (kekselat) fjerner kalium fra blodet i tarmen i bytte for en lige stor mængde natrium. Det virker langsomt, og plasmakalium begynder kun at falde inden for 1 – 2 timer. Det kan gives oralt eller som en retention enema. Den givne mængde varierer fra 30 g til 60 g. Dette kan gentages, men har tendens til at forårsage forstoppelse.
- hæmodialyse er den foretrukne behandling for patienter med fremskreden CKD og svær hyperkaliæmi.
forebyggelse
- diætrådgivning om kaliumbegrænsning.
- undgå medicin, der interfererer med renal udskillelse af kalium, f.eks. kaliumbesparende diuretika, NSAID ‘er, ACE-hæmmere, ARB’ er.
- undgå lægemidler, der interfererer med kaliumskift fra det intracellulære til det ekstracellulære rum, f.eks.
- hos udvalgte patienter med tilstrækkelig resterende nyrefunktion kan behandling med et loop-diuretikum anvendes til at stimulere udskillelse af kalium i urinen.
metabolisk acidose
metabolisk acidose er karakteriseret ved:
- lavt arterielt blod pH (acidæmi) (<7.35)
- reduceret serum HCO3-koncentration
- nedsat pCO2 (fra respiratorisk kompensation).
systemiske virkninger
metabolisk acidose kan føre til en række ændringer i væv og organer, f. eks.:
- kardiovaskulære ændringer såsom takykardi, bradykardi, hypotension og hjertesvigt
- livstruende hyperkaliæmi
- kvalme, opkastning og mavesmerter
- forvirring med depression af centralnervesystemet.
de tilknyttede symptomer og tegn afhænger af hastigheden og størrelsen af faldet i pH og af den underliggende patologi.
uræmisk acidose
metabolisk acidose forekommer ved nyresvigt på grund af nedsat evne til at udskille H+ eller manglende evne til at producere ammoniak.
i de tidlige stadier af CKD (GFR < 40 mL/min) kan metabolisk acidose med et normalt aniongab (AG) blive tydeligt. Efterhånden som CKD skrider frem (GFR <20 mL/min), kan der opstå en høj AG metabolisk acidose.
i avanceret CKD er en forøget AG typisk på grund af tilstedeværelsen af tilbageholdte syrer såsom sulfater, fosfater, urat og hippurat.
behandlingsprincipper
patienter med metabolisk acidose er ofte meget syge, og deres tilstand har tendens til at forværres hurtigt.
den rutinemæssige administration af natriumbicarbonat er kontroversiel, selvom det skal gøres for at korrigere svær acidose.
de potentielle komplikationer ved administration af natriumbicarbonat omfatter volumenoverbelastning, især hos patienter med nedsat nyre-eller hjertefunktion, hypernatriæmi, hypokaliæmi, hypokalcæmi og alkalose.
den krævede mængde bicarbonat (mmol) kan estimeres som følger:
målplasma HCO3- (mmol/L) – nuværende plasma HCO3- (mmol/L) 40% kropsvægt (kg).
anæmi i CKD
anæmi er den mest almindelige komplikation af CKD og er forbundet med stærkt nedsat livskvalitet. Vellykket behandling af anæmi ved nyresygdom kan reducere nedsat nyrefunktion. De tilstræbte hæmoglobinniveauer er 10-12 g / dl ved behandling af anæmi ved CKD. Behandlingen er dyr, og derfor er rationel overvejelse obligatorisk.
Renal anæmi
Renal anæmi er typisk normokrom normocytisk. Det skyldes hovedsageligt nedsat produktion af erythropoietin i nyrerne og dels af uræmiske toksiner. Andre årsager, der kan spille en rolle i CKD, især hos dialysepatienter, er:
- erytropoietinresistens (mest signifikant)
- knoglemarvstoksiner (ingen er blevet isoleret endnu)
- knoglemarvsfibrose, sekundært til hyperparathyroidisme
- igangværende inflammatoriske processer, f. eks. ubehandlede infektioner
- hæmatinmangel (jern, folat og vitamin B12)
- øget destruktion af røde blodlegemer
- unormale røde blodlegemer, hvilket forårsager øget osmotisk skrøbelighed
- øget blodtab fra okkult gastrointestinal blødning og blodprøveudtagning og under hæmodialyse
- Ace-hæmning.
Erythropoietin er et glykoproteinhormon, der stimulerer produktionen af røde blodlegemer ved at binde sig til erytropoietinreceptorer, som er placeret på tidlige erythroide stamceller i knoglemarven.
binding af erythropoietin til disse stamceller sparer dem for apoptose og tillader derfor celledeling og modning i røde blodlegemer. Ved CKD kan erytropoietinniveauerne være normale, men utilstrækkelige til graden af anæmi. De mekanismer, der forringer erythropoietinproduktionen i syge nyrer, forbliver dårligt forstået. Hæmning af erytropoiese med uræmiske hæmmere er også mulig og kan i høj grad bidrage til anæmi ved CKD; sådanne faktorer er ikke identificeret. Dialyse kan forbedre renal anæmi og virkningen af erytropoietinstimulerende midler. Patienter med nyresygdom kan udvikle kroniske infektioner og andre kroniske sygdomme. Kronisk sygdom bidrager til anæmi i sådanne tilfælde. Anæmi ved kronisk sygdom medieres af inflammatoriske cytokiner gennem hæmning af erytropoietinproduktion og-effekt og nedsat jerntilgængelighed.
Hepcidin er den vigtigste mediator af jernmetabolisme. I inflammatoriske tilstande blokerer hepcidin jernabsorption i tarmen og fremmer jernbinding i makrofager.
andre årsager
anæmi forbundet med CKD er mest sandsynligt renal anæmi; forskellen for andre sygdomme skal dog betragtes som sand for trin 1-3 CKD.
evalueringen af anæmi hos CKD-patienter bør omfatte et komplet blodtal med røde blodlegemer (gennemsnitlig korpuskulær hæmoglobinkoncentration, gennemsnitlig korpuskulær volumen). Renal anæmi er normalt normokrom og normocytisk. Vitamin B12 og folatmangel kan føre til makrocytose, mens jernmangel eller arvelige sygdomme i hæmoglobin kan producere mikrocytose. Jernundersøgelser bør udføres for at vurdere niveauet af jern i vævsforretninger eller tilstrækkeligheden af jernforsyning til erythropoiesis.
anæmi kan betyde forekomst af underernæring eller systemisk sygdom. Det er en uafhængig risikofaktor for hospitalsindlæggelse, CVD og dødelighed. ACE-hæmmere kan forværre anæmi.
behandling af anæmi beskytter hjertet
anæmi forværrer hjertesvigt. Behandling af anæmi er gavnlig for forventet levealder og kan også forbedre prognosen for CVD. Livskvaliteten forbedres hos patienter med et hæmoglobinniveau inden for målområdet.
målniveau for hæmoglobin
retningslinjerne for forbedring af nyresygdom (KDIGO) angiver, at hæmoglobinniveauet bør ligge i området fra 10, 0 g/dL til 12 g/dl hos patienter med kronisk nyreinsufficiens i dialyse. Prædialyseniveauer bør være ved 10 g / dL.
Rolledeling mellem nefrologer og primærlæger
tidlig henvisning til en nefrolog anbefales. Når behandlingsstrategien er besluttet, fortsætter nefrologer og primærlæger ledelsen i partnerskab.
evaluering af jernmangel
evaluering af jernunderskuddet og korrekt jernforsyning er vigtig i behandlingen af anæmi. Anæmi kan forbedres ved administration af jerntilskud, selv når patienten tilsyneladende ikke har jernmangel, da brug af rekombinant erytropoietin kan forårsage relativ jernmangel.
retningslinjerne for rekombinant humant erytropoietin i CKD er:
- serumferritin > 100 ng/mL før dialyse
- serumferritin > 200 ng/mL hos dialysepatienter
- transferrinmætning > 20%.
jern kan gives enten intravenøst eller oralt. Intravenøst jern er mere effektivt, især for dialysepatienter og patienter i behandling med erytropoietin.
anvendelse af eksogene erythropoietiner
der er i øjeblikket et antal erythropoietinstimulerende midler til rådighed, herunder ældre, kortere virkende lægemidler og nye, langtidsvirkende. Det passende middel og dosis afhænger af en række faktorer, herunder omkostninger, effektivitet og bekvemmelighed. Da disse lægemidler er dyre og har bivirkninger, overlades deres ledelse bedst til en nefrolog.
knogler og mineraler
hyperphosphatæmi er den vigtigste abnormitet, der udløser en kaskade af metaboliske hændelser, hvilket resulterer i knoglemineraltæthed af CKD.
fosfat bevares, efterhånden som nyrefunktionen forværres – meget det samme som kreatinin bevares. Denne tilbageholdelse bliver tydelig, når trin 3B CKD nås. Det vil gradvist forværres, når slutstadiet nærmer sig og skal sænkes til inden for normale grænser.
en højphosphatdiæt stimulerer osteocytter til at producere fibroblastvækstfaktor 23, som igen hæmmer hydroksyleringen af D-vitamin til aktiv 1,25 vitamin D3. Uden vitamin D3 reduceres calciumabsorptionen og knoglemodelleringen. Den resulterende hypokalcæmi er en vigtig stimulans for parathyroideahormon (PTH) frigivelse med den deraf følgende udvikling af renal knoglesygdom. Serumalkalisk phosphatase er en markør for øget knogleomsætning. Derfor viser høje blodniveauer PTH-aktivitet.
det bemærkes, at både hyperphosphatæmi og vitamin D3-mangel resulterer i øget PTH-sekretion.
oprindeligt kan stimuleringen til PTH-sekretion kontrolleres ved at øge serumkalciumet, reducere fosfatniveauerne i blodet og ordinere vitamin D3. Dette er det sekundære hyperparathyroidisme Stadium (tabel 2). Men med tiden og ukontrolleret, langvarig stimulering af PTH-sekretion bliver parathyroidhormonerne autonome, og stadiet af autonom hyperparathyroidisme nås (tabel 3). Parathyroidektomi kan nu være nødvendig, eller dyre calcimimetiske lægemidler skal administreres for at forsøge at genoprette det uordnede metaboliske miljø.


der er usikkerhed om fortolkningen af vitamin D3-niveaumålinger. Hvis de skal måles, anbefales 25-OH-vitamin D3-niveauer til vurdering.
Terapi
trinnene til terapi er vist i tabel 4. Ikke-calciumholdige fosfatbindere anbefales, når der er signifikant metastatisk forkalkning og/eller når hypercalcæmi er til stede.
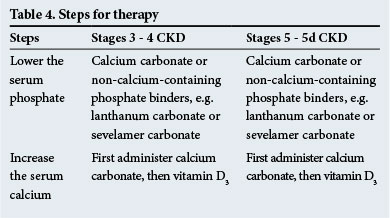
Calcimimetika, som sensibiliserer parathyroidkirtlerne til serumkalcium, er nyttige til at ordinere i hyperparathyroidisme, når serum PTH – niveauerne er høje (2 – 9 gange over det normale interval-tjek med laboratoriet for normale intervaller). De har en rolle at spille i faldende PTH-niveauer i nogen af de kliniske situationer, der opstår i CKD.
opfølgende blodmålinger
disse er angivet i tabel 5.
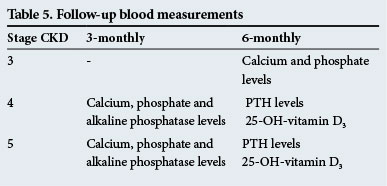
disse opfølgningstider er kun retningslinjer, og testene skal udføres oftere, hvis der er betydelige abnormiteter.
særlige punkter at bemærke
- Involver en nefrolog tidligt i løbet af CKD.
- undgå overundertrykkelse af parathyroidkirtlerne, da dette vil føre til dynamisk knoglesygdom.
- det nøjagtige PTH-niveau, hvor sekundær og autonom hyperparathyreoidisme diagnosticeres, er usikkert på grund af forskellige assays. Biokemien, som beskrevet ovenfor (sammen med røntgenbilleder af knogler), skal derefter bruges til at hjælpe med diagnosen.
- Vær opmærksom på tendenser i serumalkalisk fosfatase niveauer; niveauet kan være i det normale interval, men kan være fordoblet fra den foregående læsning.
- osteoporose ledsager knoglesygdom, der forekommer i CKD. Bisfosfonater må ikke anvendes i fase 3 – 5 CKD patienter.